
科目: 来源:山东省潍坊三县2011届高三阶段性教学质量检测化学试题 题型:022
短周期中的A、B、C、D、E5种元素,原子序数依次增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2-离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1∶1的离子化合物.
(1)E元素的离子结构示意图为________.
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为________、________.
(3)A、C元素可组成原子个数比为1∶1的共价化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为________.
(4)A、B、C、D、E中的任意三种元素可组成多种化合物,X和Y是其中的两种.X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7.
将0.2 mol·L-1的X溶液与0.1 mol·L-1的Y溶液等体积混合后,溶液呈碱性.请判断:
①X的化学式为________,Y的化学式为________;
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为________.
查看答案和解析>>
科目: 来源:山东省泰安市2011届高三上学期期末考试化学试题 题型:022
已知:A、B、C、D四种短周期元素,A与D的原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,试推断回答下列问题.
(1)D元素原子的结构示意图为________;
(2)A、B、C三种元素的原子半径由小到大的顺序为________
________(用元素符号表示);
(3)Y与C元素的最高价氧化物可以发生反应,该反应的离子方程式为________;
(4)A与D两元素的气态氢化物之间可以反应生成一种盐,该盐的水溶液呈________(填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序为________(用具体离子符号表示);
(5)实验室中,应将X的浓溶液保存在棕色试剂瓶中,其原因是________(用化学方程式表示).
查看答案和解析>>
科目: 来源:山东省济宁市一中2011届高三一轮复习质量验收化学试题 题型:022
已知甲、乙、丙为常见的单质,A、B、C、D、E、F、G、H均为常见的化合物;B和H的摩尔质量相同,E的相对分子质量比D大16,在一定条件下,各物质相互转化关系如下图所示(产物中水已忽略):
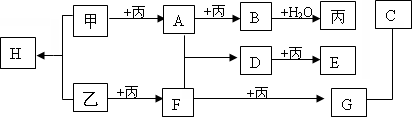
(1)写出下列物质的化学式:丙:________H:
(2)写出B和F反应的化学方程式:
(3)已知25℃,101 Kpa时,乙的燃烧热为akJ/mol,写出乙燃烧的热化学方程式________.
(4)写出B+H2O![]() 丙+C的化学方程式并标明电子转移的方向和数目:________.
丙+C的化学方程式并标明电子转移的方向和数目:________.
(5)在2 L的密闭容器内,500℃时,反应2F(g)+丙(g) 2G(g),n(F)随时间变化如下表:
2G(g),n(F)随时间变化如下表:
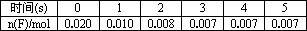
下图中表示G的变化曲线是
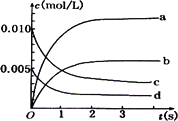
用丙表示从0~2 s内该反应的平均速率________.
查看答案和解析>>
科目: 来源:山东省济宁市一中2011届高三一轮复习质量验收化学试题 题型:022
已知由短周期元素组成的六种微粒A、B、C、D、E、F其所含原子核数目依次为2、3、4、5、1、1.其中A、B、E各含有18个电子,C、D、F各含有10个电子,A、B、C、D为常见化合物.请回答:
(1)D分子的空间构型为________.
(2)将B缓慢通入Cu(OH)2悬浊液中,浑浊液变为黑色,相应的化学方程式为________.
(3)A、C混合可生成一种新的化合物,该化合物中含有的化学键类型有________;室温下,将pH=a的C的稀溶液与pH=14-a的A稀溶液等体积混合,所得溶液中各离子浓度由大到小的顺序为________.
(4)①若E、F可按1∶1组成离子化合物X,其水溶液呈中性.请写出电解X溶液的化学方程式:________;电解时,阳极收集到的气体体积小于阴极,原因是________.
②若Y溶液中所有离子间有以下关系:c(H+)+3c(F)=c(OH-)+c(E),则:Y溶液的pH________7(填“大于”、“小于”或“等于”),原因是(用离子方程式表示)________.
查看答案和解析>>
科目: 来源:江西省南昌市南昌一中、南昌十中2011届高三第三次联考化学试题 题型:022
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:
C(s)+H2O(g)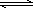 CO(g)+H2(g)
CO(g)+H2(g)
①该反应在常温下________自发进行(填“能”与“不能”);
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同).
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 mol H-O键
c.c(CO)=c(H2)
d.密闭容器的容积不再改变
(2)将不同量的CO(g)
和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)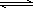 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:

①实验1中以v(CO2)表示的反应速率为________.(取小数二位,下同)
②该反应为________(填“吸”或“放”)热反应,实验2条件下平衡常数K=________.
③若实验3达平衡时与实验2平衡状态中各物质的质量分数分别相等,且t<3 min,则a、b应满足的关系是________(用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:
CO2(g)+3H2(g)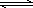 CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化.在体积为1 L的
CH3OH(g)+H2O(g),下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化.在体积为1 L的
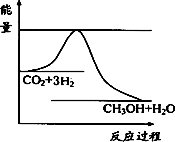
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
查看答案和解析>>
科目: 来源:江苏省海安县南莫中学2011届高三上学期期中化学试题 题型:022
二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
(1)一定条件下,2SO2(g)+O2(g) 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO3 1.8 mol,则该可逆反应的平衡常数K=________;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g),重新达到平衡后,________mol<SO3<________mol.
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO3 1.8 mol,则该可逆反应的平衡常数K=________;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g),重新达到平衡后,________mol<SO3<________mol.
(2)用CH4催化还原NOx为N2可以消除氮氧化物的污染.现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为________.
(3)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:

若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x=________.求可分解(2)中混合气体体积V(标准状况下).(写出计算过程)
查看答案和解析>>
科目: 来源:江苏省海安县南莫中学2011届高三上学期期中化学试题 题型:022
不同的金属在化学反应中表现出来的活泼程度不同,瑞典化学家贝采里乌斯和俄国化学家贝开托夫称之为金属活动顺序.另一方面,同一金属在不同条件或不同化学反应中也可以表现出不同的活泼程度.
(1)根据金属活动性顺序,工业上冶炼金属可以采用不同的冶炼方法.其中可以用“热分解法”冶炼的金属有________.
(2)
工业上用氯化铁溶液腐蚀铜制电路板.根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序:________.(3)合金Fe-Cr在不同酸中反应情况不同,其在三种稀硫酸、稀硝酸和稀盐酸中的腐蚀速率如图所示,则下列有关说法正确的是________(填写序号).

A.酸的氧化性越强,对该合金的腐蚀速率越大
B.稀硝酸对该合金的腐蚀性比另两种酸弱
C.合金中Cr含量增加,稀硝酸对该合金的腐蚀性减弱
(4)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质
(与酸不反应).某化学兴趣小组在实验室条件下,以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收.步骤一:电解精制电解时,粗铜应与电源的________极相连.电解过程中,硫酸铜的浓度会________(填“变大”、“不变”或“变小”).
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:________.
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:

从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:________.
查看答案和解析>>
科目: 来源:湖南省雅礼中学2011届高三第四次月考化学试题 题型:022
几种中学化学常见的单质及其化合物相互转化的关系图如下:
可供参考的信息有:

①甲、乙、丙、丁为单质,其余为化合物.
②A由X和Y两种元素组成,其原子个数比为1∶2,元素质量之比为7∶2∶8.
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料.
试根据上述信息回答下列问题:
(1)A的化学式为________,每反应Imol的A转移的电子数为________mol.
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:________.
(3)少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③.
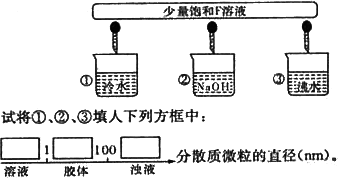
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子.试写出M在酸性环境下将G氧化为F的离子方程式:________.
查看答案和解析>>
科目: 来源:湖南省雅礼中学2011届高三第四次月考化学试题 题型:022
向体积为2 L的固定密闭容器中通人3 mol X气体,在一定温度下发生如下反应:2X(g) Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的速率为________mol/(L·min).
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)=3.5 mol/(L·min);乙:v(Y)=2 mol/(L·min);丙:v(Z)=4.5 mol/(L·min);丁:v(X)=0.075 mol/(L·s).若其它条件相同,温度不同,则温度由高到低的顺序是(填序号)________.
(3)若向达到(1)的平衡体系中充人氮气,则平衡向________(填“左”或“右”或“不”>移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向________.(填“左”或“右”或“不”)移动.
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5 mol X气体,则平衡后X的转化率与(1)的平衡中X的转化率相比较:________.
A.无法确定
B.前者一定大于后者
C.前者一定等于后者
D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为________
(6)若保持温度和体积不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为________.
查看答案和解析>>
科目: 来源:湖南省长沙市第一中学2011届高三第五次月考化学试题 题型:022
下图表示几种无机物之间的转化关系,其中A、B均为黑色粉末,B为非金属单质,C为无色无毒气体,D为金属单质,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色.
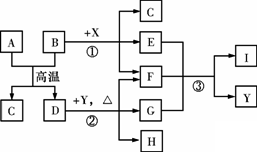
请回答下列问题:
(1)A的化学式是________,C的电子式是________,Y的名称是________.
(2)反应①的化学方程式为________.
(3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)________.
(4)19.2 g的D与足量的一定浓度X的溶液反应,将所得的气体与________LO2(标准状况下)混合,恰好能被水完全吸收.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com