
科目: 来源:浙江省嵊泗中学2012届高三上学期第二次月考化学试题 题型:022
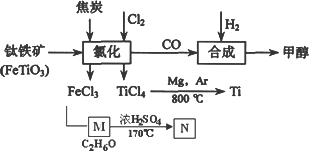
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料.由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
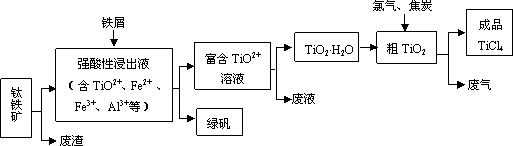
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性.该过程中有如下反应发生:2Fe3++Fe![]() 3Fe2+
3Fe2+
2TiO2+(无色)+Fe+4H+![]() 2Ti3+(紫色)+Fe2++2H2O
2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O![]() TiO2+(无色)+Fe2++2H+
TiO2+(无色)+Fe2++2H+
加入铁屑的作用是________.
(2)在②→③工艺中需要控制条件以形成TiO2·nH2O溶胶,该分散质颗粒直径大小在________范围.
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉.已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+Fe3++H2O的平衡常数K=________.
(4)已知:TiO2(s)+2Cl2(g)![]() TiCl4(l)+O2(g)ΔH=+140 KJ·mol-1
TiCl4(l)+O2(g)ΔH=+140 KJ·mol-1
2C(s)+O2(g)![]() 2CO(g) ΔH=-221 KJ·mol-1
2CO(g) ΔH=-221 KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:________.
(5)上述工艺具有成本低、可用低品位矿物为原料等优点.依据绿色化学理念,该工艺流程中存在的不足之处是________(只要求写出一项).
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用________方法.
![]()
查看答案和解析>>
科目: 来源:江西省新余一中2012届高三第三模拟考试化学试题 题型:022
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为________.利用反应
6NO2+8NH3![]() 7N2+12H2O也可处理NO2.当转移1.2 mol电子时,消耗的NO2在标准状况下是________L.
7N2+12H2O也可处理NO2.当转移1.2 mol电子时,消耗的NO2在标准状况下是________L.
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
①写出NO2氧化SO2的热化学方程式________
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________.
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
③测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________.
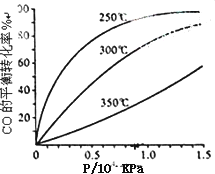
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应ΔH________0(填“>”或“<”).实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是________.
CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应ΔH________0(填“>”或“<”).实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是________.
查看答案和解析>>
科目: 来源:广西桂林中学2012届高三11月月考化学试题 题型:022
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
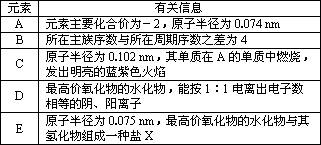
(1)画出B的离子结构示意图________;写出D元素最高价氧化物的水化物电子式________
(2)盐X水溶液显________(填“酸”“碱”“中”)性,用离子方程式解释其原因________
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同.Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液.该燃料电池放电时,正极的电极反应式是________
(5)如下图是一个电解过程示意图.假设使用Y-空气燃料电池作为本过程的
电源,铜片质量变化128 g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)________L
查看答案和解析>>
科目: 来源:云南省昆明八中2012届高三上学期期中考试化学试题 题型:022
[化学选修5——有机化学基础模块]
A是一种存在于茶叶的有机物.
已知:①A遇FeCl3溶液发生显色反应,其分子中所含的苯环上有2个取代基,取代基不含支链,
且苯环上的一氯代物只有2种.
② F结构简式为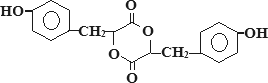 .
.
它们的转化关系如下:
请回答下列问题:
(1)有机物A中含氧官能团的名称是________;
(2)写出下列反应的化学方程式M→N:________;
(3)A→C的反应类型为________;E→F的反应类型为________;
(4)一定条件下1 mol A最多可以和________mol Br2发生反应;
(5)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方程式________.
(6)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有________种(不包括R);
查看答案和解析>>
科目: 来源:云南省昆明八中2012届高三上学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:云南省昆明八中2012届高三上学期期中考试化学试题 题型:022
已知:①25℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10.②25℃时,2.0×10-3 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

■(图有问题)
请根据信息回答下列问题:
(1)25℃时,将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1 HSCN溶液分别与20 mL 0.10 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如下图:
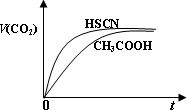
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是________,
反应结束后所得两溶液中,c(CH3COO-)________c(SCN-)(填“>”、“<”或“=”).
(2)25℃时,HF电离平衡常数的表达式Ka=________,25℃时,HF电离平衡常数Ka________.
(3)25℃时,将4.0×10-3 mol·L-1 HF溶液与4.0×10-4 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生________.
查看答案和解析>>
科目: 来源:浙江省东阳市南马高中2011届高三下学期期中考试化学试题 题型:022
利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、NH4+、Cl一四种离子,且c(NH4+)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是________.
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性:________.
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是________.
(4)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如下图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)=________mol·L-1.
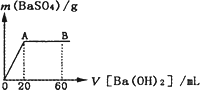
(5)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+I2(g)![]() 2HI(g) ΔH=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达
2HI(g) ΔH=-14.9 kJ·mol-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
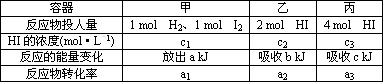
下列说法正确的是________.
A.α1+α2=1
B.2α2=α3
C.a+b=14.9
D.c1=c2=c3
查看答案和解析>>
科目: 来源:浙江省东阳市南马高中2011届高三下学期期中考试化学试题 题型:022
某短周期元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
甲+乙(1)若丙为NO2.
①甲与乙反应的化学方程式为________.
②NO2可作火箭重要燃料-肼(N2H4)的助燃剂.已知:
N2(g)+2O2(g)=2NO2(g) ΔH=+67.7 kJ·mol-1,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH=-1135.7 kJ·mol-1.
写出燃料-肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:________.
(2)若丙为SO2.
①把乙滴入硫酸铜晶体,观察到的现象是________.
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
③SO2在一定条件下,发生:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0反应.该反应的化学平衡常数K=________(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是________(填序号).
2SO3(g) ΔH<0反应.该反应的化学平衡常数K=________(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是________(填序号).
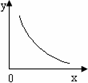
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K
查看答案和解析>>
科目: 来源:浙江省东阳市南马高中2011届高三下学期期中考试化学试题 题型:022
现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大,其中B与C、D与F分别位于同一周期,A与D、C与F分别位于同一主族,且A、D两元素原子的质子数之和是C、F两元素原子质子数之和的一半.又知六种元素所形成的常见单质在常温常压下三种是气体,三种是固体.请回答下列问题:
(1)D离子的结构示意图________;F元素氧化物的晶体类型为________.
(2)比较B、C、D元素简单离子半径的大小:________>________>________(填微粒符号)
(3)请说出C的氢化物比F的氢化物稳定的根本原因:________;用高能射线照射液态水时,一个A2C分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式:________,该阳离子中存在的化学键有________,并写出该阳离子与F氢化物的水溶液反应的离子方程式:________.
(4)E是金属元素,且E单质可以与空气中的N2、CO2等反应,E的最高价氧化物的水化物难溶于水,已知298 K时,该难溶物质的的Ksp=5.6×10-12,若此时测得溶液pH=13.00,则此温度下残留在溶液中的E离子物质的量浓度为________mol·L-1.
查看答案和解析>>
科目: 来源:山西省汾阳中学2011届高三第二次月考化学试题 题型:022
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子.有人设计了如图所示的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜.
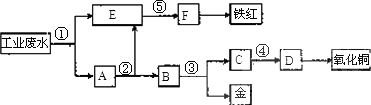
填写下面空白.
(1)图中标号处需加入的相应物质分别是①________、②________、③________、④________、⑤________.
(2)写出①处发生反应的离子方程式________;
写出③处发生反应的化学方程________.
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________;氧化铜________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com