
科目: 来源:江西省南昌一中2012届高三11月月考化学试题(人教版) 题型:022
已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为常见的无色液体.反应生成的水均已略去.它们有如下图所示的关系.

(1)写出化学式:A________,B________,J________.
(2)反应③中每生成1 mol F,转移电子的数目为________.
(3)反应④的化学方程式为:________.
(4)写出离子方程式:
反应②________;
反应⑤________.
(5)反应①中,每1.00 g C与足量的F作用,恢复到25℃放出55.6 kJ热量,写出反应①的热化学方程式________.
查看答案和解析>>
科目: 来源:江苏省泰州中学2012届高三上学期期中考试化学试题(人教版) 题型:022
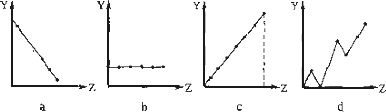
(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).请把与下面元素有关性质相符的曲线标号(a、b、c、d)填入相应的空格中:
①ⅡA族元素的最外层电子数________.
②第3周期元素的最高化合价________.
③F-、Na+、Mg2+、Al3+的离子半径________.
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①Y和M形成的常见化合物的化学式是________.
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为________,B的化学式是________.
③Z与Y形成的稳定化合物的电子式为________.
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成M单质的化学方程式:________该反应中转移的电子数目为________.
查看答案和解析>>
科目: 来源:湖北省黄冈中学2012届高三上学期期中考试化学试题 题型:022
有一无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示,请回答:

(1)淡黄色粉末为________(填名称).其电子式为________.
(2)溶液中肯定没有________离子.
(3)溶液中离子的物质的量之比为________.
(4)①淡黄色粉末与水反应的化学方程式为________,②沉淀部分减少时的离子方程式为________.
查看答案和解析>>
科目: 来源:湖北省黄冈中学2012届高三上学期期中考试化学试题 题型:022
A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图.
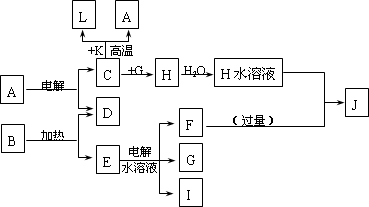
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G 为黄绿色;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃);K为红棕色粉末.
请回答:
(1)I在G中燃烧时的现象为________.
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解E水溶液的化学方程式________.
(3)写出C与K反应的化学方程式________,引发该反应的操作为________.
(4)J与H反应的离子方程式为________.若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为________.
查看答案和解析>>
科目: 来源:黑龙江省大庆铁人中学2012届高三上学期期中考试化学试题 题型:022
下图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,其中A、B、E、G、Y都含有同种VIA的元素,A和H、I含同种金属元素,但与H、I中该元素的化合价不同.E、G在常温常压下是气体,E有臭鸡蛋气味,G有刺激性气味.
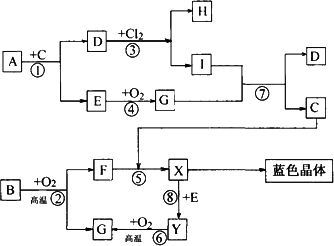
(1)写出下列物质的化学式:D________,E________.
(2)写出G通入I溶液发生反应⑦的离子方程式________.
(3)以惰性电极电解X溶液的离子方程式________.
(4)试根据B、Y与氧气反应过程中的量的变化关系,设计一个实验,不用实验室里的任何试剂,只用常用的仪器,区分B、Y两种物质(简要说明实验方法和实验结论)________
查看答案和解析>>
科目: 来源:安徽省省城名校2012届高三上学期第四次联考化学试题 题型:022
A是由X、Y、Z三种元素组成,X原子基态时3d能级上有4个未成对电子,Y元素的最外层电子排布式是4s1,内层电子全充满,Z元素最高价氧化物的水化物的浓溶液能与其氢化物发生氧化还原反应.1 molA中X、Y、Z三种元素的质子数总和为87mol,A在①反应中生成B、C、D的物质的量之比为l:4:2,且生成物之间有如下转化关系.
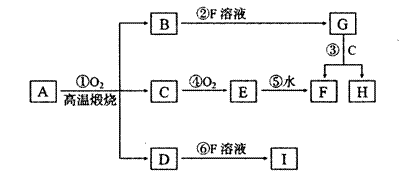
据此回答下列问题:
(1)Z元素最外层电子排布式是_________;A的化学式为_________.
(2)③反应的离子反应方程式是_________.
(3)配制H溶液的方法是_________.
(4)将C通入下列溶液中.记录的实验现象对应正确的是_________.

(5)检验G中阳离子的方法是_________.
查看答案和解析>>
科目: 来源:安徽省省城名校2012届高三上学期第四次联考化学试题 题型:022
为《京都议定书》2012年第一承诺期到期后的温室气体减排问题,世界各国都做出了不同的努力.随着新能源的开发和利用,CH3OH这个物质逐渐进入人们的视野,越来越受到人们的关注.
(1)下图是由CO(g)+2H2(g)→CH3OH(g)进行过程中的能量变化曲线.曲线a表示不使用催化剂时反应的能量变化,曲线b表示.下列相关说法正确的是_______
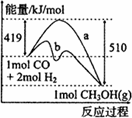
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-510 kJ/mol
CH3OH(g) ΔH=-510 kJ/mol
D.热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ/mol
CH3OH(g) ΔH=-91 kJ/mol
(2)由(1)推断,CO(g)+2H2(g)![]() CH3OH(g)在密闭容器中进行,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可采取的措施是_______
CH3OH(g)在密闭容器中进行,图中曲线a代表一定条件下该反应的过程.若使a曲线变为b曲线,可采取的措施是_______
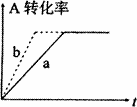
A.增大CO的浓度
B.缩小容器的容积
C.加入催化剂
D.升高温度
(3)由甲醇和氧气以及强碱做电解质溶液的新型燃料电池,正在逐步推广使用,假定放电过程中,甲醇完全氧化产生二氧化碳被充分吸收生成CO32-.该电池的负极反应的离子方程式为_________,放电过程中电池里溶液的pH将_________(填“下降”、“上升”或“不变”);若有16克甲醇被完全氧化产生电能,并利用该过程中释放的电能电解足量的硫酸铜溶液,假设能量的利用率为80%.则得到氧气的物质的量是_________.
(4)某同学将甲醇完全燃烧生成CO2气体通入200 mL 0.1 mol/L的石灰水后,得到1 g沉淀,那么通入的CO2的体积可能为(标态)_________.
查看答案和解析>>
科目: 来源:浙江省曹宅高级中学2012届高三上学期期中考试化学试题 题型:022
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
(1)NO2可用水吸收,相应的化学反应方程式为________.利用反应6NO2+8NH3![]() 7N5+12H2O也可处理NO2.当转移1.2 mol电子时,消耗的NO2在标准状况下是________L.
7N5+12H2O也可处理NO2.当转移1.2 mol电子时,消耗的NO2在标准状况下是________L.
(2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=________kJ·mol-1.
SO3(g)+NO(g)的ΔH=________kJ·mol-1.
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________.
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________.
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应ΔH________0(填“>”或“<”).实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是________.
CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如下图所示.该反应ΔH________0(填“>”或“<”).实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是________.
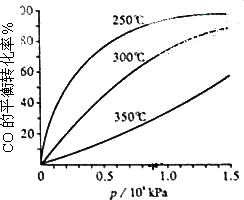
查看答案和解析>>
科目: 来源:浙江省曹宅高级中学2012届高三上学期期中考试化学试题 题型:022
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的.已知:氧化性:
IO![]() >Fe3+>I2;还原性:S2O
>Fe3+>I2;还原性:S2O![]() >I-;
>I-;
3I2+6OH-![]() IO
IO![]() +5I-+3H2O;
+5I-+3H2O;
KI+I2![]() KI3
KI3
(1)某学习小组对加碘盐进行如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得溶液分为3份.第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色.
①加KSCN溶液显红色,该红色物质是________(用化学式表示);CCl4中显紫红色的物质是________(用电子式表示).
②第二份试液中加入足量KI固体后,反应的离子方程式为________、________.
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失.
写出潮湿环境下KI与氧气反应的化学方程式:________.
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O.该物质作为食盐加碘剂是否合适?________(填“是”或“否”),并说明理由________.
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是________.
A.Na2S2O3
B.AlCl3
C.Na2CO3
D.NaNO2
(4)对含Fe2+较多的食盐(假设不含Fe3+),可选用KI作为加碘剂.请设计实验方案,检验该加碘盐中的Fe2+:________.
查看答案和解析>>
科目: 来源:浙江省嵊泗中学2012届高三上学期第二次月考化学试题 题型:022
某芳香烃X是一种重要的有机化工原料,它的蒸气密度是同温同压下氢气密度的46倍.研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去).其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO.
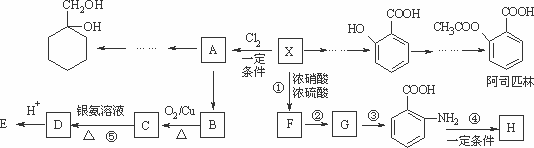
已知:
Ⅰ![]()
Ⅱ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
(1)写出反应①、③的反应类型________,________;
(2)写出反应④和⑤的化学方程式:
④________;⑤________;
(3) (水杨酸)有多种同分异构体,写出符合下列条件的结构简式________.
(水杨酸)有多种同分异构体,写出符合下列条件的结构简式________.
①属于芳香族化合物,且属于酯类;②遇FeCl3溶液显紫色;
③苯环上有两个取代基,且苯环上的一氯代物只有两种.
(4)请用合成反应流程图表示出由A和其他无机物合成 最合理的方案(不超过4步).例:
最合理的方案(不超过4步).例:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com