
科目: 来源:安徽省泗县双语中学2012届高三摸底考试化学试题 题型:022
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生.根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体.若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为________.
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收.
(3)As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O
若生成2 mol H3AsO4,则反应中转移电子的物质的量为________.若将该反应设计成一原电池,则NO2应该在________(填“正极”或“负极”)附近逸出.
(4)若反应产物NO2与11.2 L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量________(选填编号).
a.小于0.5 mol
b.等于0.5 mol
c.大于0.5 mol
d.无法确定
查看答案和解析>>
科目: 来源:江苏省南京市金陵中学2011届高三第四次模拟考试化学试题 题型:022
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
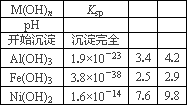
回答下列问题:
(1)用NiO调节溶液的pH,依次析出沉淀Ⅰ_________和沉淀Ⅱ_________(填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:_________.
(3)检验电解滤液时阳极产生的气体的方法:_________.
(4)写出“氧化”反应的离子方程式:__________.
(5)如何检验Ni(OH)3已洗涤干净?__________.
查看答案和解析>>
科目: 来源:福建省师大附中2012届高三上学期期中考试化学试题(人教版) 人教版 题型:022
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素符号是________.
(2)Z、W形成的气态氢化物的稳定性________>________(写化学式).
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为________.
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1 mol A能与足量NaOH浓溶液反应生成标准状况下44.8 L气体.②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式________.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1 mol B中含有6 mol结晶水.对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色.
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解.
①由实验a、b推知B溶液中含有的离子为________;
②B的化学式为________.
查看答案和解析>>
科目: 来源:河北省衡水中学2012届高三第三次调研考试化学试题(人教版) 人教版 题型:022
图中A~X分别代表一种反应物或生成物,其中F、G、X为单质,短周期元素X原予的核电荷数是其最外层和最内层电子数之和的3倍.已知A受热分解得到等物质的量的B、C、D三种气态物质,D气体能使湿润的红色石蕊试纸变蓝色,其它为化合物,图中部分生成物未列出.

请回答:
(1)B的电子式 ________,写出F的一种同素异形体________.
(2)写出反应B与X反应的化学方程式________.
(3)写出A与足量K溶液加热时反应的离子方程式________.
(4)在一定条件下,2 L的H气体与0.5 L的G气体相混合,若该混合气体被NaOH溶液恰好完全吸收,只生成一种盐.请写出该反应过程中总的化学反应方程式:________.
(5)在F与J的反应中当转移了1.5 mol电子时,产生标准状况下的I气体的体积为________L.
查看答案和解析>>
科目: 来源:河北省衡水中学2012届高三第三次调研考试化学试题(人教版) 人教版 题型:022
(Ⅰ)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物.
(1)W位于元素周期表第________周期第________族.
W的气态氢化物稳定性比H2O(g)________(填“强”或“弱”).
(2)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
________.
(3)Fe(s)+![]() O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+![]() O2(g)=X2O3(s) ΔH=-1675 kJ·mol-1
O2(g)=X2O3(s) ΔH=-1675 kJ·mol-1
X的单质和FeO反应的热化学方程式是________.
(Ⅱ)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
(1)X元素原子基态时的电子排布式为________.
(2)Y元素原子的价层电子的轨道表示式为________.
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________.
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________.
查看答案和解析>>
科目: 来源:江苏省南通市通州区2012届高三重点热点专项检测化学试题 题型:022
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g);△H1=+206.2 kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g);△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g);△H2=-35.4 kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g);△H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为________.
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________(填序号),其原因是________.
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO;△H<0
[Cu(NH3)3]Ac·CO;△H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是________.
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积VL.
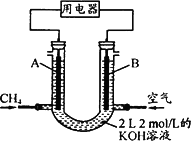
①O<V≤44.8 L时,电池总反应方程式为________;
②44.8 L<V≤89.6 L时,负极电极反应为________;
③V=67.2 L时,溶液中离子浓度大小关系为________.
查看答案和解析>>
科目: 来源:江苏省南通市通州区2012届高三重点热点专项检测化学试题 题型:022
钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂.下图是以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料生产钛白粉并获得副产品FeSO4·7H2O的工艺流程图.
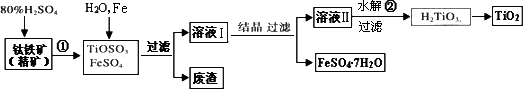
(1)钛铁矿与硫酸发生反应①的化学方程式为________;在TiOSO4和FeSO4溶液中加入Fe的目的是________.
(2)溶液Ⅱ中TiOSO4在加热条件下发生水解反应②的离子方程式为________;可回收利用的物质是________.
(3)为测定溶液Ⅱ中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O.过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用________(填一种玻璃仪器的名称)滴加0.1000 mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30.00 mL FeC13溶液.待测钛液中TiOSO4的物质的量浓度是________.
查看答案和解析>>
科目: 来源:江苏省南通市通州区2012届高三重点热点专项检测化学试题 题型:022
斑螯素能抑制肝癌的发展,去掉斑螯素中的两个甲基制得的化合物——去甲基斑螯素仍具有相应的疗效,其合成路线如下:

已知:①2HCHO+NaOH→CH3OH+HCOONa
②![]() (Diels-Alder反应)
(Diels-Alder反应)
③当每个
1,3-丁二烯分子与一分子氯气发生加成反应时,有两种产物:CH2ClCH=CHCH2Cl;CH2ClCHClCH=CH2.请回答下列问题:
(1)物质A中含有的含氧官能团名称分别为________;第①步反应中还生成另一产物,此产物的结构简式为________.
(2)写出H的结构简式________;第⑤步反应的反应类型是________.
(3)去甲基斑螯素与X互为同分异构体.X能与FeCl3溶液发生显色反应,能与Na2CO3溶液反应生成气体,且其核磁共振氢谱有4个吸收峰.写出满足上述条件的X的一种结构简式________.
(4)结合题中有关信息,写出由![]() 制备丁烯二酸酐
制备丁烯二酸酐![]() 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
________.
查看答案和解析>>
科目: 来源:山东省青州一中2012届高三化学一轮跟踪训练:第9章 第3讲 饮食中的有机化合物(鲁科版) 鲁科版 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山东省青州一中2012届高三化学一轮跟踪训练:第8章 第1讲 弱电解质的电离(鲁科版) 鲁科版 题型:022
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________.
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________.
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________.
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是________.
(5)当三者c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是________.
(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com