
科目: 来源:江苏省扬州中学2012届高三4月双周练习(一)化学试题 题型:022
草酸亚铁用作分析试剂及显影剂等,其制备流程如下:
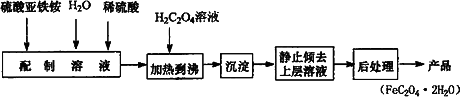
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加少量稀硫酸,目的是________.
(2)将制得的产品在氩气气氛中进行热重分析,结果如下图(TG%表示残留固体质量占原样品总质量的百分数).
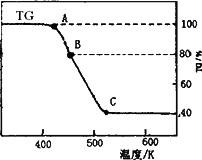
①则C处时残留物的化学式为________.
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:________.
③现取在真空中146℃脱水后的FeC2O41.44 g放在某真空的密闭容器中,再充入0.04 mol CO.加热至1100℃,其中FeO(s)+CO(g)![]() Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________.
Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?________.
(3)金属镁在国民生产中有重要作用,常以MgCl2为原料获取,温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示.结合右图请回答下列问题:
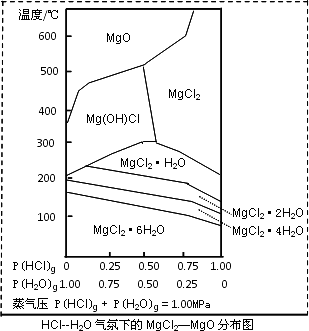
①写出P(HCl)g=0.25MPa,温度从300℃升高到550℃时反应的化学方程式________;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是________;若要得到无水MgCl2须采取的措施是________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三4月双周练习(一)化学试题 题型:022
5-氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:
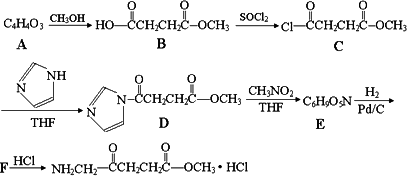
已知:R-NO2![]() -NH2
-NH2
(1)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一个峰,则A的结构简式为________.
(2)5-氨基酮戊酸盐中含氧官能团的名称是________,C→D的反应类型为________.
(3)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1 molG与足量金属Na反应能生成1 molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式________.
(4)写出D→E的反应方程式________.
(5)已知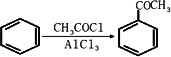 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、![]() 为原料合成
为原料合成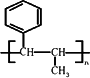 单体的合成路线流程图(无机试剂任选).
单体的合成路线流程图(无机试剂任选).
合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
________.
查看答案和解析>>
科目: 来源:天津市六校2012届高三第三次联考化学试题 题型:022
根据下表所示化学反应与数据关系:

请回答:
(1)反应①是________(填“吸热”或“放热”)反应.
(2)写出反应③的平衡常数K3的表达式________.
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示).
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有________(填写字母序号).
A.缩小反应容器的容积
B.扩大反应容器的容积
C.升高温度
D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:
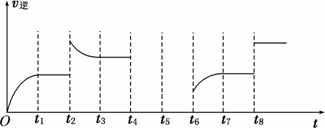
①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时________;t8时________.
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时
间的关系线.
查看答案和解析>>
科目: 来源:天津市六校2012届高三第三次联考化学试题 题型:022
某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O).
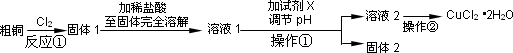
(1)实验室采用如下图所示的装置,可将反应①粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去).
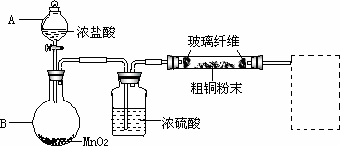
①仪器A的名称是________.
②连接好装置后,加入药品前,应该进行的实验操作是________.
③装置B中发生反应的离子方程式是________.
④有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要
(填“是”或“否”)________.
⑤虚线内缺少实验装置,请你画出装置图,标明药品名称.
(2)试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)________.
a.NaOH
b.NH3·H2O
c.CuO
d.Cu2(OH)2CO3
e.CuSO4
操作①的名称是________.
(3)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色.小
组同学欲探究其原因.
已知:在氯化铜溶液中有如下转化关系:
![]()
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是(填序号)________.
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
(4)操作②需在氯化氢气流中经过加热浓缩、________、过滤、洗涤、干燥.
查看答案和解析>>
科目: 来源:天津市六校2012届高三第三次联考化学试题 题型:022
饮料果醋中含有苹果酸,苹果酸经聚合生成聚苹果酸.已知:
(1)0.1 mol苹果酸与足量NaHCO3溶液反应能产生4.48 L CO2(标准状况);
(2)苹果酸脱水生成能使溴水褪色的产物;
(3)
RCH2Br![]() RCH2COOH.
RCH2COOH.
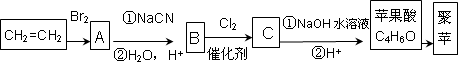
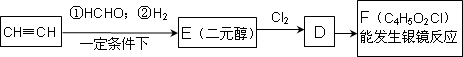
请回答:
(1)写出B的结构简式________.
(2)E的核磁共振氢谱有三组峰,其峰面积比为1∶2∶2,E的结构简式为________.
(3)写出苹果酸所含官能团的名称________,F转化成苹果酸可能发生的反应类型________.
(4)写出与苹果酸具有相同官能团的同分异构体的结构简式________.
(5)写出F与足量银氨溶液反应的化学方程式________.
(6)写出C与NaOH溶液反应的化学方程式________.
(7)聚苹果酸具有良好的生物相容性,可作为手术缝合线等材料应用于生物医药和生物材料领域.其在生物体内水解的化学方程式________.
查看答案和解析>>
科目: 来源:天津市六校2012届高三第三次联考化学试题 题型:022
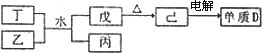
已知:A、B、D为中学化学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1∶2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件已略去).

请回答:
(1)单质A的组成元素在周期表中的位置是________.
(2)乙中所包含的化学键类型有________(填字母序号).
a.离子键
b.极性共价键
c.非极性共价键
(3)用电子式表示丙分子的形成过程________.
(4)反应①的化学方程式为________.
(5)丁的电子式为________.
(6)反应②中,0.5 mol NaClO参加反应时,转移1 mol电子,其离子方程式为:________.
(7)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为________.
查看答案和解析>>
科目: 来源:2006年普通高等学校招生全国统一考试上海卷化学 题型:022
已知![]() (注:R,
(注:R,![]() 为烃基)
为烃基)
A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如下图所示的变化.
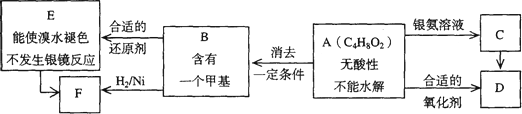
试回答
(1)写出符合下述条件A的同分异构体结构简式(各任写一种):
a.具有酸性________;b.能发生水解反应________;
(2)A分子中的官能团是________,D的结构简式是________;
(3)C→D的反应类型是________,E→F的反应类型是________;
A.氧化反应
B.还原反应
C.加成反应
D.取代反应
(4)写出化学方程式:A→B________.
(5)写出E生成高聚物的化学方程式:________.
(6)C的同分异构体Cl与C有相同官能团,两分子Cl脱去两分子水形成含有六元环的C2,写出C2的结构简式:________.
查看答案和解析>>
科目: 来源:浙江省台州中学2012届高三上学期第三次统练测化学试题 题型:022
甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系.
甲+乙→丙+丁(1)转化关系中所涉及的反应甲和乙为非氧化还原反应,且乙为水.
①若甲为固体,甲和乙反应生成的丙和丁是二种弱碱.则甲的化学式是________.
②若甲是由N和Cl元素组成的化合物,其分子结构模型如图所示,则反应的化学方程式是________.

(2)转化关系中所涉及的反应为氧化还原反应,且乙为水.
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是________.
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是________.
③若甲是由N和O元素组成的气态物质,呈红棕色.将3.36 g Fe加到一定量丙稀溶液中,收集到1.12 L气体丁(已折算为标准状况),则反应的离子方程式是________.
(3)Hofmann依据上述转化关系测定氨分子的组成.现用如图所示的装置进行实验,打开分液漏斗的活塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至三分之二处.
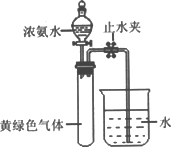
①滴下浓氨水一段时间后,试管内发生反应的化学方程式是________.
②证明试管内“不再反应”的实验操作和现象是________.
查看答案和解析>>
科目: 来源:山东省济宁市梁山二中2012届高三12月月考化学试题 题型:022
已知:A为常见的短周期轻金属,含A的合金材料常用于火箭、飞机、轮船等制造业;B是一种盐,在工农业生产中用途较广;C、F、H为常见非金属单质;常温下C、F、I、E、J和K为气体;E对空气的相对密度为0.586;G为液体.有关物质间的转化关系如下(图中部分反应物或产物已省略):

请填空:
(1)B的电子式为________;I分子的空间构型为________.
(2)反应②的实验现象为________.
(3)操作a必须在HCl气流中加热得无水物,其原因是________;操作b为________.
(4)反应①的离子反应方程式为________;反应③的化学反应方程式为________.
(5)已知C的燃烧热为286 KJ/mol,请写出表示1 g C在F中完全燃烧生成液体G的热化学反应方程式________.
查看答案和解析>>
科目: 来源:福建省福州三中2012届高三第二次月考化学试题 题型:022
短周期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的.
(1)已知相关物质之间存在如下变化:
①丁与乙和水反应生成戊和丙的离子方程式为________,由物质已电解得到单质D的化学方程式为________;
②0.1 moL/L的丙溶液中所含离子浓度由大到小排列顺序为________.
(2)已知E及其化合物有以下变化:
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式________.
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为________(任写一个即可).
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2 L的该无色气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com