
科目: 来源:辽宁省大连市2012届高三双基测试化学试题 题型:022
Ⅰ.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理.用乙烯作为还原剂将氮的氧化物还原为N2是燃煤烟气的一种脱硝(除NOx)技术.其脱硝机理如图甲,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图乙所示.
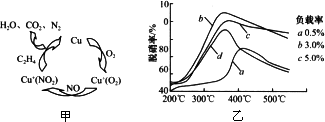
①写出该脱硝过程中乙烯和NO2反应的化学方程式________.
②为达到最佳脱硝效果,应采取的条件________.
Ⅱ.有学者设想以下图所示装置用电化学原理将燃煤烟气中的CO2、SO2转化为重要化工原料.
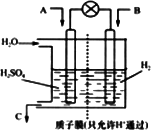
若A为SO2,B为O2,C为H2SO4.科研人员希望每分钟从C处获得50 mL 10 mol/L H2SO4,则A处通人烟气(SO2的体积分数为1%)的速率为________L/min(标准状况).
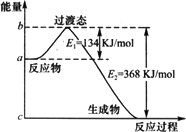
Ⅲ.(1)下图是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是________,ΔH的变化是________(填“增大”、“减小”、“不变”).
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1,
CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1,
②CH3OH(g)+![]() O2(g)
O2(g)![]() CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则甲醇蒸气完全燃烧生成液态水的热化学方程式为________.
写出甲醇燃料电池在酸性条件下的负极电极反应式________.
查看答案和解析>>
科目: 来源:陕西省西安中学2012届高三第三次月考化学试题(重点班) 题型:022
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是天然气的主要成分,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1∶1和1∶2的两种离子化合物.
(1)W在元素周期表中的位置是________周期________族.
(2)工业合成XQ3是放热反应.下列措施中,既能加快反应速率,又能提高原料利用率是________.(填写序号)
A.升高温度
B.加入催化剂
C.将XQ3及时分离出去
D.增大反应体系的压强
(3)2.24 L(标准状况)XQ3被200 mL 1 mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是________.(用离子符号表示)
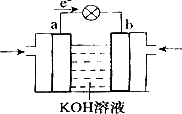
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应是________.
(5)已知:W(s)+Y2(g)=WY2(g);△H=-393.5 kJ/mol
WY(g)+![]() Y2(g)=WY2(g);△H=-238.0 kJ/mol.则24 gW与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为________.
Y2(g)=WY2(g);△H=-238.0 kJ/mol.则24 gW与一定量的Y2反应,放出热量362.5 kJ,所得产物成分及物质的量之比为________.
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式为________.
查看答案和解析>>
科目: 来源:浙江省余姚中学2012届高三第一次质检化学试题 题型:022
有可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.47,在1173K时,K=2.15.
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.47,在1173K时,K=2.15.
(1)写出该反应的平衡常数表达式________,该反应是________(选填“吸热”、“放热”)反应.
(2)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体的平均摩尔质量如何变化(选填“增大”、“减小”、“不变”).
①升高温度________
②再通入CO________
(3)该反应的逆反应速率随时间变化的关系如下图:
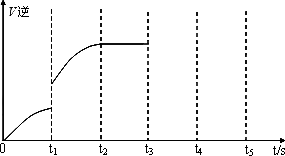
①从图中看到,反应t2时达平衡,在t1时改变了某种条件,改变的条件可能是________(填序号,答案可能不止一个).
a.升温
b.增大CO2浓度
c.使用催化剂
②如果在t3时从混合物中分离出部分CO,t4~t5时间段反应处于新平衡状态,请在图上画出t3~t5的V(逆)变化曲线
(4)能判断该反应达到平衡的依据是________.
A、容器内压强不变了
B、c(CO)不变了
C、v正(CO2)=v逆(CO)
D、c(CO2)=c(CO)
查看答案和解析>>
科目: 来源:浙江省余姚中学2012届高三第一次质检化学试题 题型:022
Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合)可消毒、漂白或作O2源….现称取一定质量的晶体加热.实验结果以温度和相对质量分数示于下图.
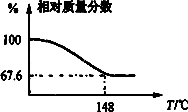
(1)写出棒状晶体的组成.________.
(2)有人认为Na2CO3·H2O2(x=1时)其实是Na2CO4·H2O(Na2CO4叫做过氧碳酸钠,Na2CO41000℃以上才分解).请你设计一个实验证明该结论的正确性.(只要求简述实验原理)
___________________________.
(3)国外的洗衣粉中常常加入适量的Na2CO4以提高洗涤质量.加入Na2CO4的作用________.试用化学方程式表示上述洗涤原理________.
(4)有人认为过氧碳酸钠可代替Na2O2,在神七航天仓供氧系统中使用,用化学方程式表示其反应原理________.
过氧碳酸钠代替Na2O2在航天仓中使用最大的不足是________.
(5)①Na2CO4与稀酸反应的离子方程式________.
②Na2CO4与SO2反应的化学方程式________.
查看答案和解析>>
科目: 来源:浙江省余姚中学2012届高三第一次质检化学试题 题型:022
A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,其中A、B的物质的量之比为1∶4.请回答:
(1)若Y是黄绿色气体,则该反应的离子方程式是________.
(2)若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是________.
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中
①A元素在周期表中的位置是________,气体Y的化学式是________.
②含a molX的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X的物质的量为________mol.
(4)若A、B、X、Y均为化合物.A溶于水电离出的金属阳离子水解的生成物可净化水,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色.则A与B按物质的量之比1∶4恰好反应,所得溶液为无色时,该溶液中离子浓度从大到小的顺序是________.
查看答案和解析>>
科目: 来源:浙江省余姚中学2012届高三第一次质检化学试题 题型:022
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO.
(1)Ca的原子结构示意图________.
(2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为________,D的沸点比A与Si形成的化合物E的沸点________.(填“高”或“低”)
(3)配平下面的化学方程式:________P+________FeO+________CaO![]() ________Ca3(PO4)2+________Fe
________Ca3(PO4)2+________Fe
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为________;检测Mn+的方法是________(用离子方程式表达).
(5)取1.6 g钙线试样,与水充分反应,生成224 mlH2(标准状况),在溶液中通入适量的CO2,最多能得到CaCO3________g.
查看答案和解析>>
科目: 来源:山东省胜利油田一中2012届高三下学期第一次调研考试化学试题 题型:022
工业上用CH4和H2O为原料通过下列反应在一定条件下制备新型燃料甲醇,反应如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
请按要求回答下列问题:
(1)将0.20 mol CH4和0.30 mol H2O(g)通入容积为2 L的密闭容器中,在一定条件下发生反应①,达到平衡时CH4的转化率与温度、压强的关系如下图.当温度不变缩小体积时此反应的逆反应速率(填“增大”、“减小”或“不变”)________;ΔH1________0,p1________p2(均填“<”、“=”或“>”);p1、100℃时平衡常数的值K=________.

(2)为了探究反应②合成甲醇适宜的温度和压强,某同学设计了以下三组实验,部分实验条件已经填在下面实验设计表中,请在空格中填入剩余的实验条件数据.

若在300℃时其他条件不变,将该反应容器容积压缩到原来的1/2,重新平衡时CH3OH的物质的量的变化是________,K的变化是________(均填“增大”,“减小”或“不变”).
(3)已知在常温常压下:2CH3OH(I)+3O2(g)![]() 2CO2(g) ΔH=-1275.6 kJ/mol
2CO2(g) ΔH=-1275.6 kJ/mol
H2O(g)=H2O(I) ΔH=-44.0 kJ/mol,请计算32 g新型燃料甲醇完全燃烧生成液态水放出热量为________kJ.
(4)新型燃料甲醇还可以用做燃烧电池,其反应原理如下图所示,电池工作时电子移动方向是(极板用M、N表示)________,负极电极反应式为________.

若以该燃料电池作为电源,用石墨作电极电解500 mL饱和食盐水,当两极共收集到1.12 L(标准状况下、不考虑气体的溶解及反应)时,常温下所得溶液的pH=________(假设反应前后溶液体积不变).
查看答案和解析>>
科目: 来源:山东省胜利油田一中2012届高三下学期第一次调研考试化学试题 题型:022
甲、乙、丙、丁是由前20号元素组成的物质,以下4种情况下的反应均符合转化关系:甲+乙→丙+丁.请按要求回答下列问题:
(1)若甲和丁是同主族元素组成的单质,且甲的组成元素位于第三周期;乙为水.
①则丙的电子式为________;
②该反应的离子方程式为________.
(2)若甲为固态离子化合物,组成它的两种元素的核电荷数之和为26;乙为水;丙为分于内既含有非极性键又含有极性键的可燃性气体.
①则丙的结构式为________;
②丁的稀溶液与盐酸反应生成1 mol水时放热为X kJ,请写出此反应的热化学方程式________.
(3)若常温下气体甲的水溶液pH大于7;乙为黄绿色气体;丙为无色气体单质,丁为固体铵盐.假设充满甲、乙两种混合气体在集气瓶中恰好完全反应,冷却后再将该集气瓶倒置于水中打开塞子,观察水倒吸入集气瓶中,剩余气体占反应前气体总体积的1/11.
①在甲与乙的反应中,甲具有(填“氧化”或“还原”)________性;
②还可以观察到集气瓶中的现象有________,其中反应的化学方程式为________.
(4)若甲为黄绿色气体单质;乙为固体氧化物,常用作肥料,其水溶液pH<7;丙为氮的氯化物;丁为HCl.当消耗6.72 L Cl2(标准状况下)时得到0.10 mol丙.
①用离子方程式表示乙的水溶液pH<7的原因:________.
②请写出该反应的化学方程式________.
查看答案和解析>>
科目: 来源:山东省济宁市微山一中2012届高三高考预测练习(1)化学试题 题型:022
A、B、C、D都是中学化学常见物质或离子,其中A、B、C均含有同一种元素,在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去,其他产物都已列出).请按要求回答下列问题:
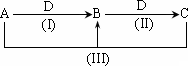
(1)若D为金属单质,且D是用量最大、用途最广的金属,若加热蒸干B的溶液没有得到B的盐,则B的化学式可能为________.
(2)若A常用作致冷剂,B和D为空气的主要成分,则反应(Ⅲ)的化学方程式为________.
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为________.
(4)若D为酸或酸性气体,也能实现上面的转化,请按A、B、C、D顺序写出合理的任意一组物质的化学式.
①当D为酸时,A________、B________、C________、D________.
②当D为酸性气体时,A________、B________、C________、D________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三4月双周练习(一)化学试题 题型:022
甲烷可制成合成气(CO、H2),再制成甲醇,代替日益供应紧张的燃油.
已知:①CH4(g)+H2O(g)=CO(g)+3H2(g);△H1=+206.2 kJ·mol-1
②CH4(g)+![]() O2(g)=CO(g)+2H2(g);△H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g);△H2=-35.4 kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g);△H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为________.
(2)从原料选择和能源利用角度,比较方法①和②,为合成甲醇,用甲烷制合成气的适宜方法为________(填序号),其原因是________.
(3)合成气中的H2可用于生产NH3,在进入合成塔前常用Cu(NH3)2Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO;△H<0
[Cu(NH3)3]Ac·CO;△H<0
Cu(NH3)2Ac溶液吸收CO的适宜生产条件应是________.
(4)将CH4设计成燃料电池,其利用率更高,装置示意如下图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积V L.
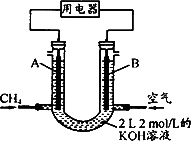
①O<V≤44.8 L时,电池总反应方程式为________;
②44.8 L<V≤89.6 L时,负极电极反应为________;
③V=67.2 L时,溶液中离子浓度大小关系为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com