
科目: 来源:河北省张家口沽源一中2012届高三高考预测化学试题 题型:022
已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素.其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍.D、E为同主族元素,且E的原子序数为D的2倍.F元素在地壳中含量位于金属元素的第二位.试回答下列问题:
(1)F元素价层电子排布式为________.
(2)关于B2A2的下列说法中正确的是________.
A.B2A2中的所有原子都满足8电子结构
B.每个B2A2分子中σ键和π键数目比为1∶1
C.B2A2是由极性键和非极性键形成的非极性分子
D.B2A2分子中的B-A键属于s-spσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是________.
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因________.
(5)A与D可以形成原子个数比分别为2∶1,1∶1的两种化合物X和Y,其中Y含有________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的电子式为________,N的结构式为________.
(6)E的氢化物的价层电子对互斥理论模型为________,E原子的杂化方式为________杂化.
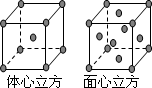
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示.面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为________,F原子配位数之比为________.
查看答案和解析>>
科目: 来源:河北省张家口沽源一中2012届高三高考预测化学试题 题型:022
钠及其化合物具有广泛的用途.
(1)工业上可利用反应Na(1)+KCl(1)![]() K(g)+NaCl(1)来治炼金属钾,此反应利用了钠的还原性及________,写出钠与TiCl4反应冶炼Ti的化学方程式________.
K(g)+NaCl(1)来治炼金属钾,此反应利用了钠的还原性及________,写出钠与TiCl4反应冶炼Ti的化学方程式________.
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如下:

负极电极反应式为________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为________.
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是________,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号).
A.HCN
B.HClO
C.CH3COOH
D.H2CO3
(4)实验室中常用NaOH来进行洗气和提纯.当300 mL 1 mol·L-1的NaOH溶液吸收标准状况下4.48 LCO2时,所得溶液中各离子浓度由大到小的顺序为________.
几种离子开始沉淀时的pH如下表:
![]()
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[(Fe(OH)2)]________Ksp[(Mg(OH))2](填“>”、“=”或“<”).
查看答案和解析>>
科目: 来源:河北省张家口沽源一中2012届高三高考预测化学试题 题型:022
铜、硫及其化合物在工业上有着重要的应用.工业上以辉铜矿(主要成分Cu2S)为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g) ΔH=-768.2 KJ·mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) ΔH=+116.0 KJ·mol-1
(1)反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的 ΔH=________.
(2)SO2气体直接排放会污染大气,对环境造成的后果是________,工业上常用氨水吸收硫酸厂尾气中的SO2,反应的化学方程式为________.
(3)该工艺炼铜的副产品SO2常用于制硫酸,其中重要的一步反应为:
2SO2(g)+O2(g)若在一个2 L的容器中充入0.4 mol SO2、0.2 mol O2和0.4 mol SO3发生上述反应.①当反应达到平衡时,各物质的浓度可能是________(选填字母标号).
A.c(SO2)=0.3 mol·L-1、c(O2)=0.15 mol·L-1
B.c(SO3)=0.4 mol·L-1
C.c(O2)=0.2 mol·L-1或c(SO2)=0.4 mol·L-1
D.c(SO3)=0.3 moI·L-1
②对于上述可能的情况,达到平衡时的平衡常数为________.
③某温度下,若将等体积的SO2和O2混合,达平衡时SO2的转化率为80%,则升高温度时SO2的转化率将________(填“增大”、“减小”或“不变”).
(4)铜和硫直接化合生成Cu2S,Cu2S和CuS都是黑色固体,都能溶于硝酸,它们高温灼烧的产物相同,鉴别CuS和Cu2S的合理方法是________.
查看答案和解析>>
科目: 来源:天津市天津一中2012届高三4月月考化学试题 题型:022
甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ,CH4的平衡转化率与温度、压强的关系如下图.
CO(g)+3H2(g)……Ⅰ,CH4的平衡转化率与温度、压强的关系如下图.
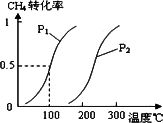
①已知100℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________.
②图中的P1________P2(填“<”、“>”或“=”),100℃时平衡常数的值为________.
③在其它条件不变的情况下降低温度,逆反应速率将________(填“增大”“减小”或“不变”).
(2)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g)……Ⅱ.
CH3OH(g)……Ⅱ.
④该反应的ΔH________0,ΔS________0(填“<”、“>”或“=”).
⑤若容器容积不变,下列措施可增加甲醇产率的是________.
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
A.请在上表空格中填入剩余的实验条件数据.
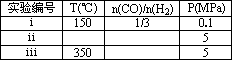
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1 MPa和5 MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强.

查看答案和解析>>
科目: 来源:天津市天津一中2012届高三4月月考化学试题 题型:022
人类最初使用的有机物大多源自于自然界,从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
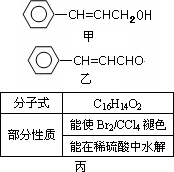
(1)甲中含氧官能团的名称为________,甲分子中处于同一平面的碳原子数最多为________个.
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
其中反应Ⅰ的反应类型为________,反应Ⅱ的化学方程式为(注明反应条件)________.
(3)已知:
![]()
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):
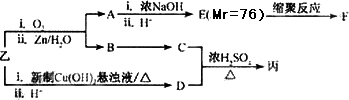
①下列物质不能与C反应的是________(选填序号)
a.金属钠
b.HBr
c.Na2CO3溶液
d.乙酸
②D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式________.
a.苯环上连接着三种不同官能团
b.能发生银镜反应
c.能与Br2/CCl4发生加成反应
d.遇FeCl3溶液显示特征颜色
③写出乙与新制氢氧化铜悬浊液反应化学方程式________.
④写出F的结构简式________.
⑤写出C和D反应生成丙的化学方程式________.
查看答案和解析>>
科目: 来源:天津市天津一中2012届高三4月月考化学试题 题型:022
下图是元素周期表的一部分

Ⅰ.用化学用语回答下列问题:
(1)②、⑥、⑧的离子半径由大到小的顺序为________.
(2)④、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是________.
(3)As的原子结构示意图为________,其氢化物的化学式为________.
(4)Y由②⑥⑧三种元素组成,它的水溶液是生活中常见的消毒剂.As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为________,当消耗1 mol还原剂时,电子转移了________mol.
Ⅱ.A、B、C、D、E、X是上述周期表给出元素组成的常见单质或化合物.已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去)

若常温下A为红棕色气体,B为强酸,X为常见金属单质
(5)A与水反应的化学方程式为________.
(6)工业上常用热还原法冶炼X,写出其化学方程式________.
(7)某温度下(﹥100℃)若m克X与H2O反应放出QKJ(Q>0)的热量,写出该反应的热化学方程式________.
(8)少量X与B的稀溶液反应生成C的离子反应方程式为________.
查看答案和解析>>
科目: 来源:河南省卫辉市第一中学2012届高三4月考试化学试题 题型:022
Cu2S是火法炼铜一种重要的原料,下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
(1)Cu2S中铜元素的化合价为________,火法炼铜的反应原理是________(用化学方程式表示).
(2)Cu2O,CuO加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式:________.
(3)若将A中单质反应,操作加入试剂最好是________.
A.加入适量的NaNO3
B.适量的HNO3
C.适量的H2O2
(4)若B溶液的体积为0.2 L,电解B溶液一段时间后溶液的pH值由2变为1(体积变化忽略不计),此时电解过程中转移电子数的物质的量是________.
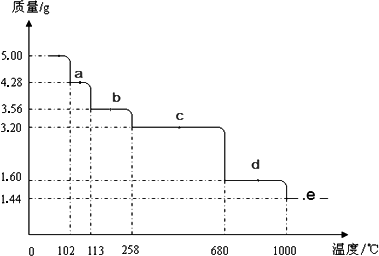
(5)取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线如下图所示:通过计算确定258℃时发生反应的化学方程式________,e点的化学式________(计算过程略去).
查看答案和解析>>
科目: 来源:河南省卫辉市第一中学2012届高三4月考试化学试题 题型:022
已知短周期主族元素X、Y、Z、W,原子序数依次增大且X和Y的原子序数之和等于Z的原子序数,X和Z可形成X2Z,X2Z2两种化合物,W是短周期主族元素中半径最大的元素.
(1)W在周期表中的位置:________.
(2)在一定条件下,容积为1 L密闭容器中加入1.2 mol X2和0.4 mol Y2,发生如下反应:3X2(g)+Y2(g)![]() 2YX3(g) ΔH反应各物质的量浓度随时间变化如下:
2YX3(g) ΔH反应各物质的量浓度随时间变化如下:
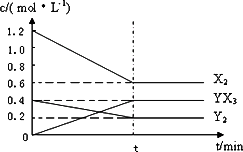
①此反应的平衡常数表达式为________(用化学式表示),K=________.
②若升高温度平衡常数K减小,则ΔH________0(填>,<).
(3)A1是四种元素中三种元素组成的电解质,溶液呈碱性,将0.1 mol·L-1的A1溶液稀释至原体积的10倍后溶液的pH=12,则A1的电子式为________.
(4)B1、B2是由四种元素三种形成的强电解质,且溶液呈酸性,相同浓度时B1溶液中水的电离程度小于B2溶液中水的电离程度,其原因是________.
(5)A2和B1反应生成B2,则0.2 mol/L A2和0.1 mol/L B1等体积混合后溶液中离子浓度大小关系为________.
查看答案和解析>>
科目: 来源:河南省卫辉市第一中学2012届高三4月考试化学试题 题型:022
1 L某混合溶液,可能含有的离子如下表:
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如下图所示.
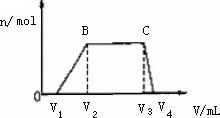
则该溶液中一定不含有的离子是________.
(2)BC段离子方程式为________.
(3)V1、V2、V3、V4之间的关系________.
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:

①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为________.
②原溶液中Cl-、Br-、I-的物质的量浓度之比为________.
查看答案和解析>>
科目: 来源:辽宁省大连市2012届高三双基测试化学试题 题型:022
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
(1)Z2+的核外电子排布式是________.
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键.
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________.
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________,其中心原子的杂化类型是________.
(6)若电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取________.
A.电子的运动轨迹图像
B.原子的吸收光谱
C.电子体积大小的图像
D.原子的发射光谱
(7)某元素原子的价电子构型为3d54S1,该元素属于________区元素,元素符号是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com