
科目: 来源:2013年普通高等学校招生全国统一考试天津卷理综化学 题型:022
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)________
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)________
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系
其中C是溶于水显酸性的气体;D是淡黄色固体.写出C的结构式________;D的电子式________
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________由A转化为B的离子方程式________.
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性.用离子方程式表示A溶液显碱性的原因________.A、B浓度均为0.1 mol/L的混合溶液中,离子浓度由大到小的顺序是________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有________.
查看答案和解析>>
科目: 来源:2013年普通高等学校招生全国统一考试安徽卷理综化学 题型:022
有机物F是一种新型涂料固化剂,可由下列路线合成(部分反应条件略去):
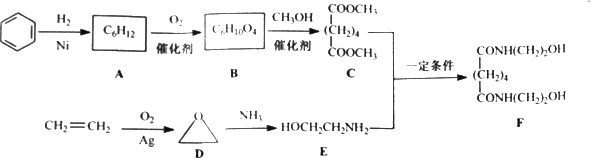
(1)B的结构简式是________;E中含有的官能团名称是________.
(2)由C和E合成F的化学方程式是________.
(3)同时满足下列条件的苯的同分异构体的结构简式是________.
(4)乙烯在实验室可由________(填有机物名称)通过________(填反应堆类型)制备.
(5)下列说法正确的是________.
a.A属于饱和烃
b.D与乙醛的分子式相同
c.E不能与盐酸反应
d.F可以发生酯化反应
查看答案和解析>>
科目: 来源:2013年普通高等学校招生统一考试(江苏卷)化学试题 题型:022
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在.它的单质和化合物在工农业生产中有着重要的应用.
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得.相关热化学方程式如下:2Ca3(PO4)2(s)+10C(s)![]() 6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g) ΔH1=+3359.26 kJ·mol-1
CaO(s)+SiO2(s)![]() CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s)![]() 6CaSiO3(s)+P4(s)+10CO(g) ΔH3则ΔH3=________kJ·mol-1.
6CaSiO3(s)+P4(s)+10CO(g) ΔH3则ΔH3=________kJ·mol-1.
(2)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P4+60CuSO4+96H2O![]() 20Cu3P+24H3PO4+60H2SO4
20Cu3P+24H3PO4+60H2SO4
60 mol CuSO4能氧化白磷的物质的量是________.
(3)磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示.
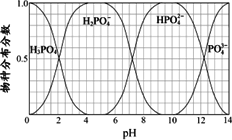
①为获得尽可能纯的NaH2PO4,pH应控制在________;pH=8时,溶液中主要含磷物种浓度大小关系为________.
②Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________(用离子方程式表示).
(4)磷的化合物三氯氧磷(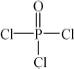 )与季戊四醇(
)与季戊四醇( )以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.
)以物质的量之比2∶1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X的核磁共振氢谱如下图所示.
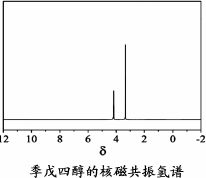
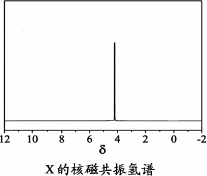
①酸性气体是________(填化学式).
②X的结构简式为________.
查看答案和解析>>
科目: 来源:2013年普通高等学校招生统一考试(江苏卷)化学试题 题型:022
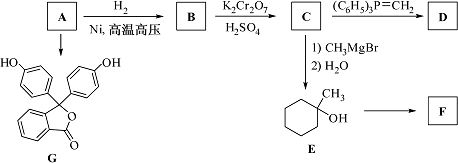
化合物A(分子式为C6H6O)是一种有机化工原料,在空气中易被氧化.A的有关转化反应如下(部分反应条件略去):
已知:①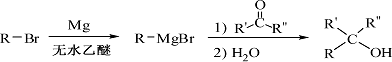
②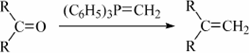 (R表示烃基,
(R表示烃基,![]() 和
和![]() 表示烃基或氢)
表示烃基或氢)
(1)写出A的结构简式:________.
(2)G是常用指示剂酚酞.写出G中含氧官能团的名称:________和________.
(3)某化合物是E的同分异构体,且分子中只有两种不同化学环境的氢.写出该化合物的结构简式:
________(任写一种).
(4)F和D互为同分异构体.写出反应E→F的化学方程式:________.
(5)根据已有知识并结合相关信息,写出以A和HCHO为原料制备![]() 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
![]()
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第二次综合考试化学试题 题型:022
在元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高.
(1)B元素在周期表中的位置;D元素基态原子电子排布式为________.
(2)E的气态氢化物在同族元素中沸点最高的原因是:________.
(3)A、C两元素第一电离能________.(填元素符号)
(4)B元素能形成多种配合物.元素之间形成配合物的条件是:一方是能够提供孤对电子的原子,另一方是的原子.
(5)A元素可与氢元素形成离子化合物,电子式为________;这种离子化合物可与水反应,化学方程式为________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三最后冲刺热身化学试题 题型:022
(1)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化铝、硫化镉、硫化锌薄膜电池等.
①第一电离能:As________Se(填“>”、“<”或“=”).
②二氧化硒分子的空间构型为________.
③砷化铝晶体结构与硅相似,在砷化铝晶体中,每个Al原子与________个A s原子相连.
(2)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构如下图:试回答下列问题
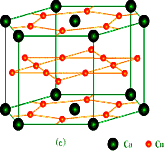
①在周期表中Ca处于周期表________区.
②铜原子的基态核外电子排布式为:________.
③已知镧镍合金LaNin晶胞体积为9.0×10-23 cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n=________(填数值);氢在合金中的密度为:________.
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60.非常适于实际应用.Ca32C60上可吸附至少92个氢分子.有关说法正确的是________.
A.钙的电负性比锶的小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时,储氢质量分数Ca32C60比Sr32C60高
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三最后冲刺热身化学试题 题型:022
合成氨联产二甲醚是一项具有中国特色的化工工艺,具有节能环保,其工艺流程如下:
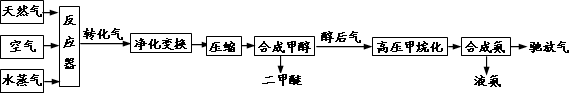
已知造气时,主要发生的反应有:CH4+H2O→CO+3H2………①;2CH4+O2→2CO+4H2………②.
CO、CO2均可与H2合成甲醇,合成甲醇后排出的醇后气中有很少量的CO、CO2,需与H2转化为甲烷,防止CO使合成氨催化剂中毒.
(1)已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1323 kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1;及CO的燃烧热:283 kJ·mol-1.
在一定条件下,CO、H2能生成二甲醚和气态水,该热化学方程式为________.(本题涉及的条件均在同一条件下)
(2)相同体积的天然气,采用“合成氨同时联产二甲醚”和直接合成氨相比,新工艺优越性有________.
a.减少二氧化硫排放
b.适应低碳经济
c.可提高氮肥产量
d.资源综合利用率和经济效益高
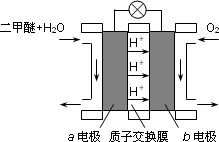
(3)下图为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极的电极反应式为________.
(4)假定造气时产生的转化气中不含CO2,H2与CO物质的量之比为2.2,空气由80% N2和20% O2组成,天然气中CH4为100%,且①和②的转化率均为100%.则同温同压下通入的空气和水蒸气的体积比,V(空气)/V(水蒸气)=________.
(5)今有224 m3(已折合成标准状况)由CO、H2、N2组成的混合气体,分别合成甲醇和氨,且三种气体均完全转化,驰放气中甲烷忽略不计,若得到液氨34 kg,则同时得到二甲醚________千克?
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三最后冲刺热身化学试题 题型:022
随着工业的迅速发展,产生的废水对水体的污染也日趋严重.通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的方法.下表是常温下金属氢氧化物的K sp(沉淀溶解平衡常数)和金属离子以氢氧化物沉淀所需的pH.
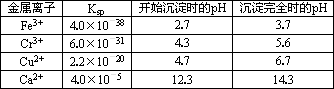
(1)某厂排出的废水中含有Cu2+和Fe3+,测得其浓度均小于0.1 mol·L-1.为除去其中的Fe3+,回收铜,需控制的pH范围是________.
(2)为了处理含有Cr2O72-酸性溶液的工业废水,采用如下方法:向废水中加人适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准.
①Cr2O72-转变为Cr3+的离子方程式为________.
②pH对废水中Cr2072-去除率的影响如下图.

你认为电解过程中溶液的pH取值在________范围内对降低废水中的铬含量最有利,请说明理由:________.[注:去除率(%)=[(c0-c)/co]×100%,式中:co-处理前废水中Cr2O72-的浓度,c-处理后废水中Cr2O72-的浓度]
(3)沉淀转化在生产中也有重要应用.例如,用Na2CO3溶液可以将锅炉水垢中的CaSO4转化为较疏松而易清除的CaCO3,该沉淀转化达到平衡时,其平衡常数K=________(写数值).[已知Ksp(CaSO4)=9.1x10-6,Ksp(CaCO3)=2.8×10-9]
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三最后冲刺热身化学试题 题型:022
黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:
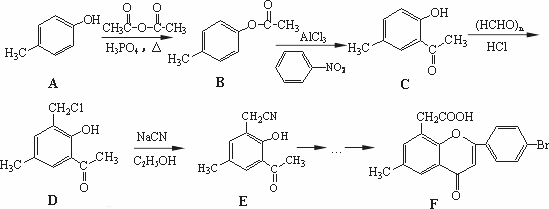
已知:RCN在酸性条件下发生水解反应:
(1)写出A转化为B的化学方程式________.
(2)F分子中有3个含氧官能团,名称分别为羰基、________和________.
(3)E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为________.
(4)写出符合下列条件的D的两种同分异构体的结构简式________、________.
①分子中有4种化学环境不同的氢原子;②可发生水解反应,且一种水解产物能与FeCl3发生显色反应,另一种水解产物能发生银镜反应.
(5)对羟基苯乙酸乙酯(![]() )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
CH3CH2OH![]() H2O=CH2
H2O=CH2![]()
![]()
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三最后冲刺热身化学试题 题型:022
工业生产无铁硫酸铝,以硫酸浸取铝土矿得含铁(Fe2+和Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,Fe(OH)3和二氧化锰发生吸附共沉作用,最终得到无铁硫酸铝产品.

(1)KMnO4首先将Fe2+氧化为Fe3+,其本身被还原为MnO2,反应的离子方程式为________.
(2)写出高锰酸钾溶液和硫酸锰溶液反应的化学方程式________.实验证明,n(MnO2)/n(Fe)控制在4∶1时,除铁效果较好.若溶液中亚铁离子和铁离子浓度均为0.03 mol/L,为达到较好的除铁效果,每1 L溶液应加入高锰酸钾的物质的量为________.
(3)调节pH的作用是________.
(4)操作1的名称为________,操作2的名称为________.
(5)下列有关工艺的说法正确的是________.(填字母序号)
A.可以向溶液中再加入铝土矿粉等调节pH
B.溶液的碱性越强,则除铁效果越好,但同时会影响硫酸铝的产率
C.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本
D.可以直接向溶液中加入二氧化锰粉末以除去Fe(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com