
科目: 来源:上海市徐汇区2013年高考一模试卷化学试题 题型:022
黄酮醋酸(F)具有独特抗癌活性,它的合成路线如下:
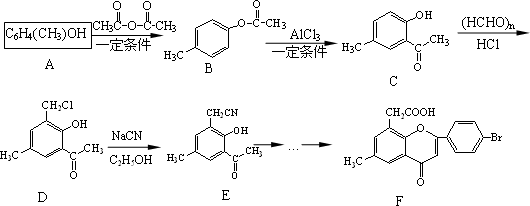
已知:RCN在酸性条件下发生水解反应:
1.写出A转化为B的化学方程式________.
2.F分子中有3个含氧官能团,名称分别为醚键、________和________.
3.E在酸性条件下水解的产物可通过缩聚反应生成高分子化合物,该高分子化合物的结构简式为________.
4.写出符合下列条件的D的两种同分异构体的结构简式________.
①分子中有4种化学环境不同的氢原子
②可发生水解反应,且一种水解产物含有酚羟基,另一种水解产物含有醛基.
5.对羟基苯乙酸乙酯(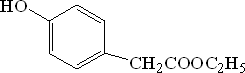 )是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).
)是一种重要的医药中间体.写出以A和乙醇为主要原料制备对羟基苯乙酸乙酯的合成路线流程图(无机试剂任选).
查看答案和解析>>
科目: 来源:上海市普陀区2013年高考一模化学试题 题型:022
兔耳草醛是食品与化妆品工业中的香料添加剂.工业上可通过有机化工原料A制得,其合成路线如下图所示:
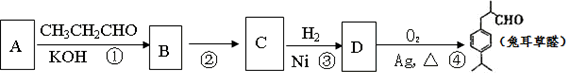
已知:①2CH2=CH2+O2![]() 2CH3CHO
2CH3CHO
②CH3CHO+CH3CHO![]() CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO
完成下列填空:
1、A的结构简式是________,B的结构简式是________.
2、上述合成路线中属于加成反应的有________(填写反应编号).
3、写出由D获得兔耳草醛的化学反应方程式________.
4、A的同分异构体中符合以下条件的有________种.
a.能使FeC13(aq)显紫色
b.能发生加聚反应
c.苯环上只有两个互为对位的取代基
5、简要写出证明C中含有碳碳双键的实验步骤________.
查看答案和解析>>
科目: 来源:上海市普陀区2013年高考一模化学试题 题型:022
某校化学小组的同学将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计了如下制备硫酸铜和硫酸铝晶体的方案:
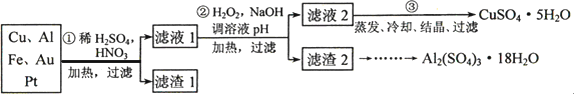
回答下列问题:
1、第①步参加反应的金属有________种.
2、第②步加入H2O2是因为滤液1中含有________离子.使用H2O2的优点是________.
3、用第③步所得CuSO4·5H2O制备无水硫酸铜的方法是:________.
4、请帮助化学小组的同学完成由滤渣2制取Al2(SO4)3·18H2O的实验步骤:
(1)取滤渣2,加入足量的________,充分反应后过滤;
(2)取滤液,加入足量的________(填写试剂的化学式),然后________(填写所需实验操作的名称);
(3)用适量稀硫酸溶解;
(4)最后经过________(填写所需实验操作的名称),获得Al2(SO4)3·18H2O晶体.
5、第③步所得CuSO4·5H2O含有可溶性杂质Na2SO4.为了用重量法测定CuSO4·5H2O的纯度,选用BaCl2(aq)和其他必要的试剂,请列出必须测定的物理量________.
查看答案和解析>>
科目: 来源:上海市杨浦区2013年高考一模化学试题 题型:022
硫有多种化合物,许多含硫化合物在工业上有重要的用途.
1.工业上可用黄铁矿、焦炭在有限的空气中燃烧制备硫磺.
3FeS2+12C+8O2A是________(写化学式).若得到192克的硫磺,则产生标准状况下的A气体________L.
2.硫的氯化物常做橡胶工业的硫化剂.硫与氯气在一定条件下反应,得到两种硫的氯化物B和D.B物质中的含硫量为0.3107,D物质中的含氯量为0.5259,B的相对分子质量比D小32.计算确定这两种氯化物的分子式分别为________.
3.硫化氢有毒.在120℃、101 kPa,将H2S和O2在密闭容器中点燃,充分反应后又恢复到了原来的温度和压强时,气体体积减少30%,求原混合其气体中H2S的体积分数.写出推导过程.(不考虑硫化氢的分解)
4.硫代硫酸钠是重要的还原剂,可用亚硫酸钠和硫粉在水溶液中加热制得.取15.12 g Na2SO3溶于80.0 mL水中,加入5.00 g硫粉,用小火加热至微沸,反应约1小时后过滤,将滤液蒸发至体积为30.0 mL,再冷却到10℃,则理论上析出Na2S2O3?5H2O多少克?写出推导过程.(已知:Na2S2O3的溶解度,10℃时为60.0 g/100 g水,100℃时为207 g/100 g水.100℃时,Na2S2O3饱和溶液的密度为1.14 g/mL).
查看答案和解析>>
科目: 来源:上海市杨浦区2013年高考一模化学试题 题型:022
化合物M广泛应用于化学合成行业.其两种合成路线如下图所示.

已知:①-CH2CN-CH2COONa+NH3
②-C(OH)3COOH+H2O
完成下列填空:
1.反应Ⅰ的反应类型是________反应;反应Ⅱ的反应条件是________.
2.写出结构简式.A________;H________.
3.写出D→E的化学反应方程式________.
4.与M有相同的官能团的M的同分异构体共有________种(不考虑顺反异构).
5.用于纸张涂膜等的S.B.R乳胶,是由M、苯乙烯、1,3-丁二烯共聚生成,写出该乳胶的结构简式________(不考虑单体比例).
6.实验室用2%的硝酸银溶液和2%的氨水配制银氨溶液.简述银氨溶液的配制过程________.
查看答案和解析>>
科目: 来源:天津市十二区县重点学校2012届高三毕业班联考(二)化学试题 题型:022
化学将对人类解决资源问题作出重大贡献.
乙基香草醛(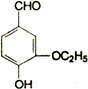 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.
(1)写出乙基香草醛的分子式________,分子中所含官能团的名称:醚键、________、________.
(2)乙基香草醛不能发生下列反应中的________(填序号).
①消去反应
②水解反应
③加成反应
④取代反应
⑤氧化反应
⑥显色反应
⑦还原反应
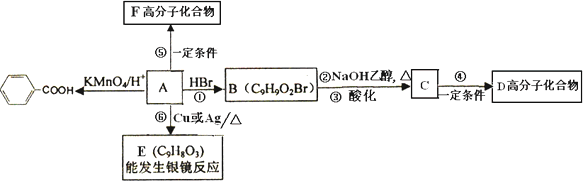
(3)乙基香草醛的同分异构体A是一种有机酸,A可发生以下变化:
提示:与苯环直接相连的碳原子上有氢时,此碳原子才可被酸性高锰酸钾溶液氧化为羧基
(a)写出A的结构简式________.反应①的反应类型为________.
(b)写出反应②的化学方程式________.
写出反应⑤的化学方程式________.
写出反应⑥的化学方程式________.
(c)C的同分异构体中,与C含有相同官能团且具有顺反异构现象,写出其顺式结构的结构简式:________.
(4)乙基香草醛有多种同分异构体,写出符合下列条件的结构简式________.
①属于酯类
②能与新制氢氧化铜加热后反应生成红色沉淀
③苯环上有两个处于邻位的取代基,其中一个是羟基
查看答案和解析>>
科目: 来源:天津市十二区县重点学校2012届高三毕业班联考(二)化学试题 题型:022
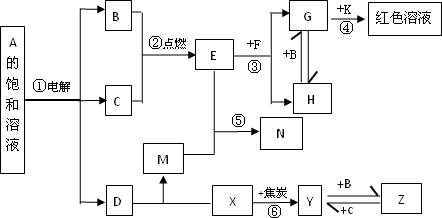
物质A~Z有下图所示的转化关系(部分反应物与产物已略去).其中,常温下B、C为气体单质,Y为固体单质,Y是电子工业中常用的半导体材料.F是具有磁性的黑色晶体.E的水溶液与M混合后得到N,N经过干燥脱水可得到一种常用于实验室和袋装食品、瓶装食品等的干燥剂.
请回答:
(1)K的化学式________;Z的电子式________;D中存在的化学键类型为________;
(2)反应①的离子方程式________;反应③的化学方程式________;
(3)向H的水溶液中加入足量氨水并将溶液露置在空气中,观察到的现象是________;
(4)写出反应⑥的化学方程式________;该反应中每消耗1 mol X,转移电子________mol.
查看答案和解析>>
科目: 来源:北京市海淀区2012届高三5月查漏补缺化学试题 题型:022
有机化合物F是合成电子薄膜材料高聚物Z和增塑剂P的重要原料.
(1)某同学设计了由乙烯合成高聚物Z的3条路线(Ⅰ、Ⅱ、Ⅲ)如下图所示.
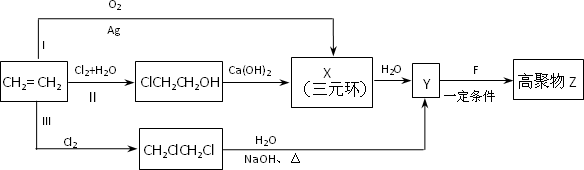
①3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“Ⅰ”、“Ⅱ”或“Ⅲ”)________.
②X的结构简式是________.
③1 mol F在O2中充分燃烧,生成CO2和H2O的物质的量之比为8∶3,消耗7.5 mol O2.F的核磁共振氢谱中有3个吸收峰,能与NaHCO3反应生成CO2,不能使Br2的CCl4溶液褪色.
F分子中含有的含氧官能团的名称是________.
Y+F→Z反应的化学方程式是________.
(2)已知:![]() (R、
(R、![]() 代表烃基或氢原子)合成P的路线如下图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
代表烃基或氢原子)合成P的路线如下图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.

①A→B反应的化学方程式是________.
②B→C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氢原子.C的结构简式是________.
③P的结构简式是________.
④符合下列条件的B的同分异构体共有(填数字)________种.
a.在酸性条件下水解为M和N
b.一定条件下M可以转化为N
查看答案和解析>>
科目: 来源:北京市海淀区2012届高三5月查漏补缺化学试题 题型:022
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂.其部分工艺流程如下:
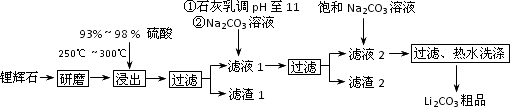
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度( s)如下表所示.
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质.则步骤Ⅱ中反应的离子方程式是________.
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3.向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________.
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是________.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入稍过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阳极的电极反应式是________.
②b中,生成Li2CO3反应的化学方程式是________.
查看答案和解析>>
科目: 来源:北京市海淀区2012届高三5月查漏补缺化学试题 题型:022
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=a kJ·mol-1的平衡常数随温度的变化如下表:
H2(g)+CO2(g) ΔH=a kJ·mol-1的平衡常数随温度的变化如下表:
(1)上述正反应方向是________反应(填“放热”或“吸热”).
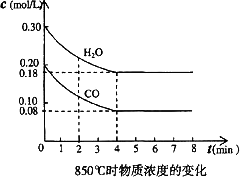
(2)850℃时在体积为10 L反应器中,由图可知到4 min时反应能量变化51.6 kJ,则a=________.
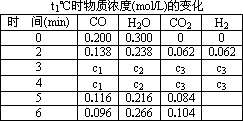
(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①与2 min时相比,3 min时密闭容器中混合气体的平均摩尔质量________(填增大、减小或不变).
②表中3 min~4 min之间反应处于________状态;CO的体积分数________16%(填大于、小于或等于).
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是________(单选),表中5 min~6 min之间数值发生变化,可能的原因是________(单选).
A.增加水蒸气
B.降低温度
C.使用催化剂
D.增加氢气浓度
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020 mol/L,在该条件下,CO的最大转化率为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com