
科目: 来源:天津市耀华中学2012届高三第一次模拟考试化学试题 题型:022
有机物A可作为合成降血脂药物安妥明( )和碳酸酯工程塑料(
)和碳酸酯工程塑料( )的原料之一.
)的原料之一.
相关的合成路线如下:

已知:
①同一个碳原子上接两个或三个羟基的有机物分子结构不稳定,会发生变化,如:
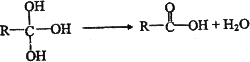
②某些醇或酚可以与碳酸酯反应生成聚碳酸酯,如:
![]()
回答下列问题:
(1)已知A的分子式为C3H6O,其一氯代物只有一种,则A的结构简式为________;1 mol A消耗氧气________mol.
(2)安妥明的核磁共振氢谱有________个峰.E→安妥明反应的化学方程式是________.
(3)C可能发生的反应类型________.
A.取代反应
B.加成反应
C.消去反应
D.还原反应
(4)F的结构简式是________.
(5)E的同分异构体X.同时符合下列条件:
①X能与饱和溴水发生取代反应
②X的苯环上有2个取代基,且苯环上的一溴取代物只有2种
③1 mol X与足量NaHCO3溶液反应生成1 mol CO2与足量Na反应生成1 mol H2
④X与NaOH水溶液发生取代反应所生成的宫能团能被连续氧化为羧基
写出两种X可能的结构简式:
________、________.
查看答案和解析>>
科目: 来源:天津市耀华中学2012届高三第一次模拟考试化学试题 题型:022
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
(1)C的元素符号是________;B的最高价氧化物的电子式为________;元素F在周期表中的位置________.
(2)B、C、D元素的氢化物的沸点由商到低的顺序为________(用化学式表示).
(3)将足量D的单质通入到A2E的溶液中,反应的化学方程式为________
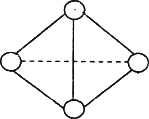
(4)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4气态分子.C4分子结构如图所示,已知断裂1 mol C-C吸收l67 KJ的热量,生成1 mol C=C放出942 KJ热量.试写出由C4气态分子变成C2气态分子的热化学方程式:________.
(5)某盐x(C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分步水解而呈弱酸性.
①盐x显酸性原因(用离子方程式表示)________.
②写出足量金属镁加入盐x的溶液中产生H2的记学方程式为________
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三下学期质量检测(三)化学试题 题型:022
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三下学期质量检测(三)化学试题 题型:022
随着氮氧化物污染的日趋严重,国家将于“十二五”期间加大对氮氧化物排放的控制力度.目前,消除氮氧化物污染有多种方法.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
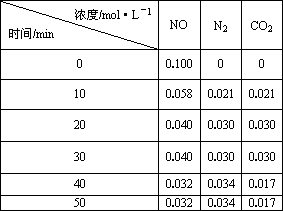
①T1℃时,该反应的平衡常数K=________(保留两位小数).
②30 min后,改变某一条件,反应重新达到平衡,则改变的条件可能是________.
③若30 min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,则该反应的△H________0(填“>”、“=”或“<”).
(2)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式________.
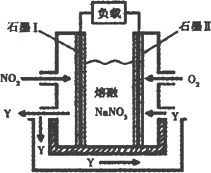
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,有关电极反应可表示为________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三下学期质量检测(三)化学试题 题型:022
止咳酮(F)具有止咳、祛痰作用.其生产合成路线如下:

(1)写出B中含有的官能团名称:________.
(2)已知B→D反应属于取代反应,写出C(C属于氯代烃)的结构简式:________.
(3)写出E→F的反应类型:________.
(4)满足下列条件的E的同分异构体有________种.
①苯环上有两个邻位取代基;
②能与FeCl3溶液发生显色反应;
③除苯环外不含其它的环状结构.
(5)写出A→B的反应方程式:________.
(6)A→F六种物质中含有手性碳原子的是:________(填物质代号).
(7)目前我国用粮食发酵生产丙酮(CH3COCH3)占较大比重.利用题给相关信息,以淀粉为原料,合成丙酮.合成过程中无机试剂任选.
提示:合成路线流程图示例如下:
![]()
查看答案和解析>>
科目: 来源:上海市嘉定区2013年高考一模化学试题 题型:022
6-羰基庚酸是一种重要的化工中间体,下面合成它的流程图:

已知:

1、反应①的条件是________,反应类型是________.
2、下列说法中正确的是________:
a.1 mol C与足量的Na反应生成1 mol H2
b.C能被催化氧化成酮
c.Ni催化下1 mol G最多只能与1 mol H2加成
d.F能发生消去反应生成两种不同烯烃
3、E与新制Cu(OH)2反应的化学方程式为________.
4、G的同分异构体有多种.请写出结构中含有 、且属于酯类的同分异构体:________、________、________.
、且属于酯类的同分异构体:________、________、________.
5、已知“Diels-Alder反应”为:![]() ,物质D与呋喃(
,物质D与呋喃(![]() )也可以发生“Diels-Alder反应”,该化学反应方程式为:________.
)也可以发生“Diels-Alder反应”,该化学反应方程式为:________.
查看答案和解析>>
科目: 来源:上海市奉贤区2013年高考一模化学试题 题型:022
5-氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:
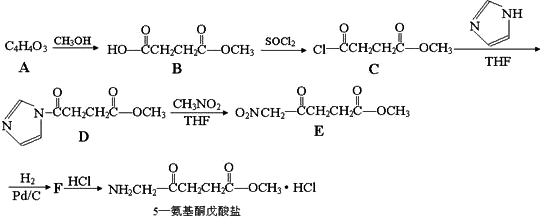
已知:![]()
1.5-氨基酮戊酸盐中非含氧官能团的名称是________.
2.C→D的反应类型为________.
3.已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一种环境的氢原子,则A的结构简式为________.
4.G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1 molG与足量金属Na反应能生成1 molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式________.
5.写出D→E反应的化学方程式________.
6.已知,请结合题中所给信息,写出由CH3CH2COOH、![]() 为原料合成
为原料合成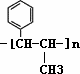 单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).
单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).
(1)第一步的合成路线:________.
(2)最后一步的化学方程式:________.
查看答案和解析>>
科目: 来源:上海市奉贤区2013年高考一模化学试题 题型:022
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁.其生产步骤如下:
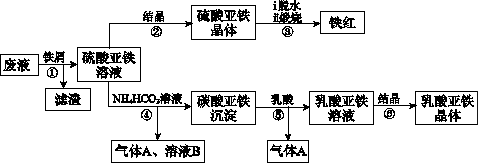
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-.请回答:
1.步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是________.步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、________.
2.步骤④的离子方程式是________.
3.步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及________.
4.硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为________.
5.用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因________.
6.为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应).若消耗0.1000 mol·L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示)________.
查看答案和解析>>
科目: 来源:上海市宝山区2013年高考一模化学试题 题型:022
那格列奈是一种新型的餐时血糖调节剂,适用于Ⅱ型糖尿病.其合成路线如下:
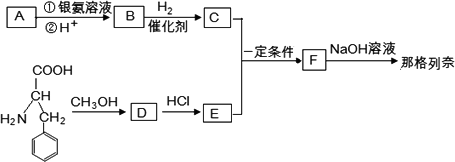
已知:

1.有机物A蒸气密度是相同状态下氢气密度的74倍,A分子中碳元素的质量分数是氢元素质量分数的10倍,A的1个分子中含有1个氧原子,A中含氧官能团的名称为________;A的分子式为________.
2.已知A的结构满足以下条件:
①含有苯环,苯环上有两个取代基;
②苯环上的一溴取代物只有两种;
③取代基上有三种不同的氢原子.
写出A的结构简式:________.
3.写出流程中制取D的化学方程式:________.
4.由F制取那格列奈的反应类型是________.
5.1 mol B与3 mol H2加成得到C,写出C和E制取F的化学方程式:________.
6.物质B分子的取代基上一个氢原子被1个溴原子取代后,再消去1个HBr得到有机物G,下列关于G的说法正确的是________(选填字母编号).
a.能使酸性高锰酸钾溶液褪色
b.分子中有7种不同的氢原子
c.能与碳酸氢钠反应放出气体
d.B经上述过程可以得到两种同分异构体
查看答案和解析>>
科目: 来源:上海市宝山区2013年高考一模化学试题 题型:022
食用加碘盐的生产流程如下:
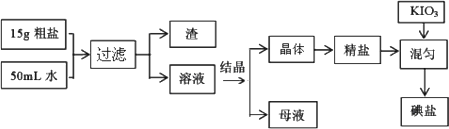
1.检验母液中是否含有SO42-离子的方法是________.
2.过滤时,用到的玻璃仪器有:________、________、________.
3.国家标准GB546061-92规定碘盐含碘量(以碘计):出厂产品≥40 mg/Kg;销售品≥30 mg/Kg.某次实验时向一干净的坩埚中放入5 g精盐,加入1 mL0.001 mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1 h,即得碘盐产品,该碘盐的含碘量约为________mg/Kg(保留一位小数),是否为合格产品________(选填“合格”或“不合格”).
4.检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O→3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要使用的一种试剂是________.
5.使用碘盐时,要防止高温,是因为:①碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体中加硝酸酸化的硝酸银溶液有黄色沉淀生成;② 碘盐在热水中,也会反应生成两种单质,其中一种是无色气体,在反应后的溶液中滴加酚酞试液显红色.根据以上信息写出①、②中发生反应的化学方程式:
①________;
②________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com