
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:022
根据图示回答下列问题:

(1)写出A、E、G的结构简式:
A________,E________,G________.
(2)反应②的化学方程式(包括反应条件)是________.
反应④化学方程式(包括条件)是________.
(3)写出①⑤的反应类型:①________;⑤________.
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:022
反应aA(g)+bB(g)![]() cC(g)(ΔH<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
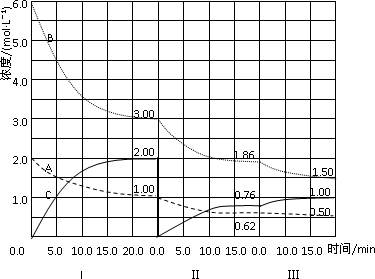
回答问题:
(1)反应的化学方程式中,a∶b∶c为________;
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________;
(3)B的平衡转化率αI(B)、αⅡ(B)、αⅢ(B)中最小的是________,其值是________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是________,采取的措施是________;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”“<”“=”),判断的理由是________;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
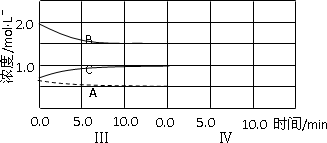
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:022
臭氧是一种强氧化剂,常用于消毒、灭菌等.
(1)O3与KI溶液反应生成的两种单质是________和________.(填分子式)
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示.已知:O3的起始浓度为0.0216 mol/L.①pH增大能加速O3分解,表明对O3分解起催化作用的是________.

②在30°C、pH=4.0条件下,O3的分解速率为________mol/(L·min).
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________.(填字母代号)
A.40℃、pH=3.0
B.10℃、pH=4.0
C.30℃、pH=7.0
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得.
①图中阴极为________(填“A”或“B”),其电极反应式为________.

②若C处通入O 2 ,则A极的电极反应式为________.
③若C处不通入O 2 ,D、E处分别收集到xL和有yL气体(标准情况),则E处收集的气体中O 3 所占的体积分数为________.(忽略 O 3 的分解).
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:022
下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出).
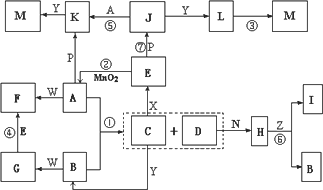
请按要求回答:
(1)写出C的电子式________,I的化学式________;
(2)反应③的化学方程式为________;
(3)反应④的离子方程式为________;
(4)由C制取E时反应物的状态是________,由J制取L时反应的环境是________.
物质结构元素周期律
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:022
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质).现用A与石墨作电极,B的浓溶液作电解质,构成原电池.有关物质之间的转化关系如下图:
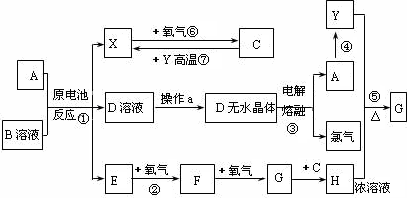
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
________.
(2)从D溶液制备D的无水晶体的“操作a”为________.
(3)反应②的化学方程式为________.
(4)反应⑤的化学方程式为________.
(5)原电池反应①中正极的电极反应式为________.
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:022
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca.
(1)Ca的原子结构示意图________.
(2)配平用钙线氧脱磷的化学方程式:
________P+________FeO+________CaO![]() ________Ca3(PO4)2+________Fe
________Ca3(PO4)2+________Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为________,检测Mn+的方法是________(用离子方程式表达).
(4)取1.6 g钙线试样,与水充分反应,生成224 ml H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3________g.
(5)处理炼钢厂含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S.
已知:CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=YO2(g);ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是________.
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:022
在下列各变化中,E为常温下无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).回答下列问题:

(1)在反应②中,每生成2.24 L气体G(标准状况)时,该反应转移电子的物质的量是________.
(2)若反应①在常温下进行,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则反应①的离子方程式是________.
(3)若反应①在加热条件下进行,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是________.
(4)若反应①在溶液中进行,A是一种常见一元强碱,B是一种酸式盐,D是一种气体,且B遇盐酸有气体产生,在加热条件下,当A过量时,反应①的离子方程式是________.
(5)若反应①在溶液中进行,A是一种强酸,B是一种含有两种金属元素的盐,且B的水溶液显碱性,A、B均由短周期元素组成,当A过量时,C及D均易溶于水,则A过量时反应①的离子方程式是________.
查看答案和解析>>
科目: 来源:江苏省徐州市2012届高三考前信息卷化学试题 题型:022
通常状况下,过氧化氢是一种无色透明的液体,在实验室和生产中应用广泛.
(1)火箭推进器中分别装有联氨(N2H4)和过氧化氢,它们发生反应的热化学方程式为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1
H2O(l)=H2O(g) △H=44 kJ·mol-1
请写出N2H4(l)与O2(g)反应生成N2(g)和H2O(l)的热化学方程式:________.
(2)H2O2是一种二元弱酸,其第一步电离的电离方程式为________.
(3)过二硫酸铵法是目前最流行的制备H2O2的方法.即电解含H2SO4的(NH4)2SO4溶液制取(NH4)2S2O8,如下图所示,再加热水解即可得H2O2和(NH4)2SO4.

①电解时,阳极的电极方程式________;
②写出生成H2O2的反应的化学方程式:
________.
(4)Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能降解有机污染物p-CP.控制p-CP的初始浓度相同,在不同实验条件下进行如下实验,测得p-CP的浓度随时间变化关系如下图所示.
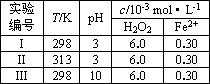
①请根据实验I的曲线,计算降解反应在50~150 s内的反应速率ν(p-CP)=________mol·L-1·s-1.
②实验I、II表明,温度升高,降解反应速率增大.但温度过高时反而导致降解反应速率减小,请分析原因:________.
③实验III得出的结论是:pH=10时,________.
查看答案和解析>>
科目: 来源:江苏省徐州市2012届高三考前信息卷化学试题 题型:022
盐酸阿立必利是一种强效止吐药.它的合成路线如下:
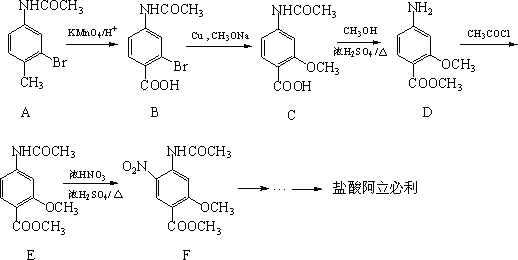
(1)有机物D中含有的官能团有酯基、________、________.
(2)由E生成F的反应类型为________.
(3)写出同时满足下列条件的D的一种同分异构体G的结构简式:________.
①属于α-氨基酸;
②能与FeCl3溶液发生显色反应;
③分子中有一个手性碳原子,有6种不同化学环境的氢.
(4)高聚物H由G通过肽键连接而成,H的结构简式是________.
(5)写出由C生成D的化学方程式:________.
(6)已知:![]() .请写出以
.请写出以 、CH3CH2CH2COCl为原料制备
、CH3CH2CH2COCl为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
合成路线流程图示例如下:
![]()
查看答案和解析>>
科目: 来源:天津市耀华中学2012届高三第一次模拟考试化学试题 题型:022
二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ、(1)合成二甲醚反应一:![]()
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是________.
A、低温高压
B、加催化剂
C、体积不变充入N2
D、增加CO浓度
E、分离出二甲醚
(2)合成二甲醚反应二:2CH3OH(g)![]() CH3OCH3(g)+H2O(g).在不同温度下,分别在1 L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:
CH3OCH3(g)+H2O(g).在不同温度下,分别在1 L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:

该反应是________(填“放热”或“吸热”)反应,原因是________(从平衡常数角度说明).
Ⅱ、二甲醚燃料电池的工作原理如下图一所示.

(1)该电池正极的电极反应式为________.
电池在放电过程中,b对应的电极周凰溶液的pH________.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1 L 0.1 mol/L KCl溶液,写出电解总反应的离子方程式为________.
(3)室温时,按上述(2)电解一段时间后,取25 mL上述电解后溶液,滴加0.2 mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在________区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com