相关习题
0 95659 95667 95673 95677 95683 95685 95689 95695 95697 95703 95709 95713 95715 95719 95725 95727 95733 95737 95739 95743 95745 95749 95751 95753 95754 95755 95757 95758 95759 95761 95763 95767 95769 95773 95775 95779 95785 95787 95793 95797 95799 95803 95809 95815 95817 95823 95827 95829 95835 95839 95845 95853 203614
科目:
来源:华侨中学2006-2007学年高三化学第四次统考试题
题型:038
|
|
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:

| (1) |
|
曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式):
________,各种溶质的物质的量之比为________;加盐酸后产生CO2体积的最大值为________mL.
|
|
(2) |
|
曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式):________,各种溶质的物质的量之比为________;加盐酸后产生CO2体积的最大值为________mL.
|
|
(3) |
|
|
查看答案和解析>>
科目:
来源:华侨中学2006-2007学年高三化学第四次统考试题
题型:038
|
|
右图为某市售盐酸试剂瓶标签上的部分数据.问:

| (1) |
|
(2) |
|
取该盐酸25.4mL与2.00mol/L的氢氧化钠溶液100mL混合,再将混合后溶液稀释至1.00L,此时溶液的pH约为多少?
|
|
|
查看答案和解析>>
科目:
来源:湖南师大附中2006-2007学年度上学期高三月考试卷(四)、化学试题
题型:038
|
|
将碳酸氢铵和熟石灰的混合物共0.6mol加入到密闭容器中,加热至200℃充分反应后,排出气体,冷却后称量固体剩余物,测得固体质量为ag.
| (1) |
|
若碳酸氢铵和熟石灰以等物质的量混合,则所发生的反应的化学方程式为________,a=________g(2分)
|
|
(2) |
|
若以x表示混合物中碳酸氢铵的物质的量分数,计算确定a随x变化的数学表达式(4分).
|
|
|
查看答案和解析>>
科目:
来源:湖南师大附中2006-2007学年度上学期高三月考试卷(三)、化学试题
题型:038
|
|
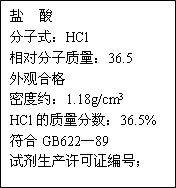
右图为某市售盐酸试剂瓶标签上的部分数据.问:
| (1) |
|
(2) |
|
取40gMnO2与该盐酸在加热条件下反应,欲制得标准状况下的氯气8.96L,取该盐酸的体积至少为________mL.
|
|
(3) |
|
|
查看答案和解析>>
科目:
来源:湖南省永州市四中2006-2007届高三化学第一次月考试卷
题型:038
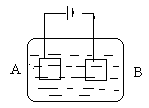
按下面的装置进行电解实验,A极是均匀的铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,A极全部溶解,此时B极增重7.68g,溶液质量增加0.03g.求A合金中Cu、Zn的质量各为多少.
查看答案和解析>>
科目:
来源:湖南长沙长郡中学2007届高三第一次月考、化学试卷
题型:038
燃烧1.00t含硫质量分数为48.0%的黄铁矿矿石,若在生产过程中,黄铁矿的利用率为90.0%,硫酸的产率为85.0%,且还有质量分数为1.50%的硫留在炉渣里.试计算能够生产多少吨H2SO4质量分数为98.0%的硫酸.
查看答案和解析>>
科目:
来源:北京市东城区2004—2005学年度第一学期期末教学目标检测、高三化学
题型:038
|
|
NaHCO3和KHCO3的混合物6.2g与100mL盐酸恰好完全反应,得到标准状况下CO2的体积为1.568L.
| (1) |
|
(2) |
|
|
查看答案和解析>>
科目:
来源:2006年普通高等学校招生全国统一考试(上海)、化学
题型:038
|
|
已知:4NH3+5O2 4NO+6H2O 4NO+6H2O
4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算
| (1) |
|
amolNO完全转化为HNO3需要氧气________mol
|
|
(2) |
|
为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为________(保留2位小数).
|
|
(3) |
|
20.0 moL的NH3用空气氧化,产生混合物的组成为:NO18.0 mol、O212.0 mol、N2150.0 mol和一定量的硝酸,以及其它成分.(高温下NO和O2不反应)计算氨转化为NO和HNO3的转化率.
|
|
(4) |
|
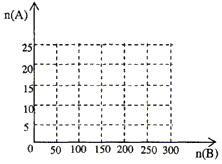
20.0 moL的NH3和一定量空气充分反应后,再转化为HNO3
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.
②写出当125≤n(B)≤200时,n(A)和n(B)的关系式________.
|
|
|
查看答案和解析>>
科目:
来源:2006年普通高等学校招生全国统一考试(上海)、化学
题型:038
|
|
合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3
| (1) |
|
某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4:5,其中Fe2+与Fe3+物质的量之比为________.
|
|
(2) |
|
当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为________(用小数表示,保留2位小数).高温
|
|
(3) |
|
以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:2Fe2O3十C 4FeO十CO2↑.为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为________g. 4FeO十CO2↑.为制得这种活性最高的催化剂,应向480g Fe2O3粉末中加入炭粉的质量为________g.
试题答案:
|
|
|
查看答案和解析>>
科目:
来源:2006年普通高等学校招生全国统一考试(江苏省)、化学
题型:038
|
|
计算题
氯化亚铜(CuCl)是重要的化工原料.国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%.工业上常通过下列反应制备CuCl2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
| (1) |
|
CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,试计算配置该溶液所需的CuSO4·5H2O与H2O的质量之比.
|
|
(2) |
|
准确称取所配置的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液.有关反化学反应为:
Fe3++CuCl===Fe2++Cu2++Cl-
Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准.
|
|
|
查看答案和解析>>

