相关习题
0 95660 95668 95674 95678 95684 95686 95690 95696 95698 95704 95710 95714 95716 95720 95726 95728 95734 95738 95740 95744 95746 95750 95752 95754 95755 95756 95758 95759 95760 95762 95764 95768 95770 95774 95776 95780 95786 95788 95794 95798 95800 95804 95810 95816 95818 95824 95828 95830 95836 95840 95846 95854 203614
科目:
来源:江苏省苏州中学2006-2007学年度高三化学初考试卷
题型:038
|
|
将4molSO3气和4molNO置于2L容器中,一定条件下发生如下可逆反应(不考虑NO2和N2O4之间的相互转化):2SO3(g) 2SO2+O22NO+O2 2SO2+O22NO+O2 2NO2 2NO2
| (1) |
|
当上述系统达到平衡时,O2和NO2的物质的量分别为n(O2)=0.1mol、n(NO2)=3.6mol,则此时SO3气体的物质的量为________.
|
|
(2) |
|
当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是SO3和________,或NO和________(填它们的分子式).
|
|
(3) |
|
若在另外一个2L的容器中只发生反应2NO+O2 2NO2,其中NO、O2、NO2的起始浓度依次是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,各物质的浓度可能是(填字母代号)________. 2NO2,其中NO、O2、NO2的起始浓度依次是0.2mol/L、0.1mol/L、0.2mol/L,当反应达到平衡时,各物质的浓度可能是(填字母代号)________.
A、c(NO)=0.35mol/L或c(NO)=0.09mol/L
B、c(NO2)=0.4mol/L
C、c(NO2)=0.35mol/L
D、c(O2)=0.2mol/L或c(NO)=0.4mol/L
|
|
|
查看答案和解析>>
科目:
来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷
题型:038
|
|
为测定一置于空气中的某硫酸酸化的FeSO4溶液中Fe2+被氧化的百分率,某同学准确最取pH=1(忽略Fe2+、Fe3+的水解)的FeSO4溶液200mL,加入过量BaCl2溶液,充分反应后过滤、洗涤、干燥,得到沉淀28.0g;再另取同样的FeSO4溶液200mL,向其中加入过量NaOH溶液,搅拌使其充分反应,待沉淀全部变为红褐色后,过滤、洗涤并灼烧所得固体,最终得固体8.0g.
| (1) |
|
通过计算,填写下表:
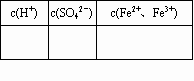
注:c(Fe2+、Fe3+)表示Fe2+和Fe3+的总的物质的量的浓度
|
|
(2) |
|
(3) |
|
当Fe2+部分被氧化时,试推导c(Fe2+、Fe3+)与c(H+)、c(SO42-的关系.
|
|
|
查看答案和解析>>
科目:
来源:江苏省前黄高级中学2007届高三年级第一学期期中考试、化学试卷
题型:038
|
|
将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol.(有关反应方程式:①N2O4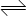 2NO2;②2NO2+2NaOH=NaNO2+NaNO3+H2O;③NO+NO2+2NaOH=2NaNO2+H2O) 2NO2;②2NO2+2NaOH=NaNO2+NaNO3+H2O;③NO+NO2+2NaOH=2NaNO2+H2O)
| (1) |
|
若A=0.8,则原0.8mol混合气体能否被烧碱溶液完全吸收?若能,当B=1.0时,原0.8mol混合气体中各气体的物质的量为多少?若不能,该问不用回答.
|
|
(2) |
|
(3) |
|
求A=0.8时,气体与碱反应所得溶液中NaNO3的物质的量(可用含有关字母的代数式表示).
|
|
|
查看答案和解析>>
科目:
来源:江苏省江浦高级中学2006-2007学年高三年级第二次月考、化学试卷
题型:038
|
|
为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2、(NH4)2SO4和NH4HSO4固体.为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如表(标准状况):
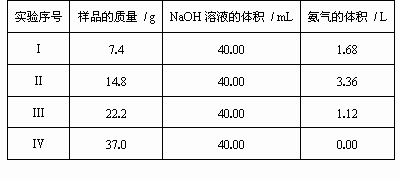
| (1) |
|
实验过程中有关反应的离子方程式为________,________.
|
|
(2) |
|
由Ⅰ组数据直接推测:标准状态下3.7g样品进行同样实验时,生成氨气的体积为________L.
|
|
(3) |
|
试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比________.
|
|
(4) |
|
欲计算该NaOH溶液的物质的量浓度应选择第________组数据,由此求得NaOH溶液的物质的量的浓度为________.
|
|
|
查看答案和解析>>
科目:
来源:江苏省江浦高级中学2006-2007学年高三年级第二次月考、化学试卷
题型:038
已知KMnO4、MnO2在酸性条件下将草酸钠(Na2C2O4)氧化,离子反应为:
2MnO4—+5C2O42—+16H+==2Mn2++10CO2↑+8H2O
MnO2+C2O42—+4H+==Mn2++2CO2↑+2H2O
为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g无水草酸钠固体,再加入足量的稀硫酸(杂质不反应),充分反应后将所得溶液转移到250mL容量瓶中,用蒸馏水稀释至刻度,摇匀后从中取出25.00mL,再用0.02mol/LKMnO4溶液滴定.当滴入20.00mLKMnO4溶液时恰好完全反应.求该软锰矿中MnO2的质量分数.
查看答案和解析>>
科目:
来源:江苏省江浦高级中学2006-2007学年高三年级第二次月考、化学试卷
题型:038
|
|
二十一世纪人类健康杀手是心血管疾病.科学家发现某药物X能治疗心血管疾病.醇A可合成X.已知4.60g醇A置于5.00LO2中充分燃烧后恢复到标准状况下,体积缩小了0.56L,再将混合气体通过足量的碱石灰,气体体积又缩小了3.36L.
| (1) |
|
试计算:
①、参加反应的O2的体积V(O2)=________L,生成的CO2体积V(CO2)=________L.
②、该醇的化学式满足下列________通式.(填编号)通过计算确定醇的化学式:________.
A、CX(H2O)Y
B、(CXHY)a(H2O)b
C、(CXOY)a(H2O)b
|
|
(2) |
|
烃B和醇A,不论等质量还是等物质的量条件下充分燃烧,生成的水量总是相等.试写出烃B在一定条件下和硝酸反应的化学方程式;________.
|
|
(3) |
|
A、B的沸点谁高________,可能原因________.
|
|
|
查看答案和解析>>
科目:
来源:江苏省淮安中学2007届高三化学第二次月考试卷
题型:038
|
|
硝酸工业尾气中氮的氧化物(NO、NO2)是大气污染物,可用基于下列反应的方法治理:2NO2+2NaOH→NaNO3+NaNO2+H2O
NO+NO2+2NaOH→2NaNO2+H2O;
| (1) |
|
若在标准状况下有NO、NO2的混合物恰好与50mL2.0mol·L-1的NaOH溶液反应完全,且生成NaNO2和NaNO3的物质的量的比值为4:1,则在混合气体中NO气体的体积分数为________?
|
|
(2) |
|
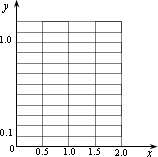
设NO、NO2的混合气体用NOx表示,用碱液吸收,生成硝酸钠及亚硝酸钠再结晶分离.若生产每吨硝酸钠的成本为0.16万元,生产每吨亚硝酸钠的成本为0.27万元.目前市场出售价:硝酸钠每吨0.18万元,亚硝酸钠每吨0.28万元.则每处理22.4×109L(标准状况)含NOx(x≥1.5)0.1%(体积分数)的尾气,所得利润y(出售价减去成本价,单位:万元)与x的关系为________.(附解题过程)
|
|
(3) |
|
根据⑵的计算结果,在以下坐标系中作出其示意图.
|
|
|
查看答案和解析>>
科目:
来源:江苏省淮安中学2007届高三化学第二次月考试卷
题型:038
|
|
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.钒元素广泛分散于各种矿物中,钾钒铀矿的主要成分可用化学式表示为K2H6U2V2O15,测定其中钒元素含量的方法是:先把矿石中的钒元素转化为V2O5(钒元素的化合价不变),V2O5在酸性溶液里转化为VO2+,再用草酸等测定钒.总反应可表示为:
□VO2++□H2C2O4+□H+ □VO2++□CO2+□H2O □VO2++□CO2+□H2O
| (1) |
|
(2) |
|
现有钾钒铀矿样品10.2g,用上述方法来测定钒的含量,结果消耗0.9g草酸,那么此钾钒铀矿中钒元素的质量分数是________.若用氧化物的形式表示钾钒铀矿的主要成分,其化学式为________.
|
|
|
查看答案和解析>>
科目:
来源:江苏省邗江中学2006~2007学年度第一学期高三化学期中试卷(旧人教) 旧人教
题型:038
|
|
由CO2、H2O(g)组成的混合气体共amol,其中CO2的物质的量分数为x.将该混合气体缓慢通过装有1molNa2O2的真空管,充分反应后,维持1.01×105Pa,120℃收集所得气体,冷却、称量,真空管中固体质量增加yg.
| (1) |
|
若a=1,则y=________(用含x代数式表示).
|
|
(2) |
|
(3) |
|
若a=2,试讨论:x取值不同时,反应后所得气体成份及y的表达式(不一定填满).
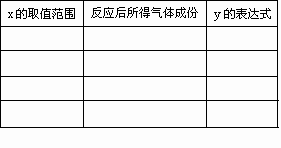
|
|
(4) |
|
若a=1.25,试作图表示y与x的关系(关键点要标明数据).
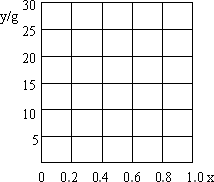
|
|
|
查看答案和解析>>
科目:
来源:江苏省邗江中学2006~2007学年度第一学期高三化学期中试卷(旧人教) 旧人教
题型:038
|
|
将25.6gCu投入50mL12mol/L的浓硝酸中,充分反应后,收集到4.48L(标准状况)NO和NO2的混合气体.
| (1) |
|
(2) |
|
判断25.6gCu和50mL12mol/L的硝酸反应后何者有剩余?________.其物质的量是________.
|
|
(3) |
|
如果4.48L(标准状况)NO和NO2的混合气体是通过排水法进行收集,则收集到的气体的体积(标准状况)是________.
|
|
(4) |
|
如果往反应后的体系内再加入200mL4mol/L的稀硫酸,又有气体逸出,写出离子反应方程式,并计算新产生气体的体积(标准状态).
|
|
|
查看答案和解析>>
