相关习题
0 95664 95672 95678 95682 95688 95690 95694 95700 95702 95708 95714 95718 95720 95724 95730 95732 95738 95742 95744 95748 95750 95754 95756 95758 95759 95760 95762 95763 95764 95766 95768 95772 95774 95778 95780 95784 95790 95792 95798 95802 95804 95808 95814 95820 95822 95828 95832 95834 95840 95844 95850 95858 203614
科目:
来源:浙江九所重点中学2006-2007学年度高三化学调研考试题
题型:038
|
|
现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100mL2.0mol·L—1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140mL4.0mol·L—1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0.
| (1) |
|
(2) |
|
|
查看答案和解析>>
科目:
来源:新星高级中学2006-2007学年高三统一考试、化学专业试卷(一)(人教) 人教
题型:038
标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol·L-1、密度为0.915g·cm-3的氨水.试计算1体积水吸收多少体积的氨气可制得上述氨水.(本题中氨的相对分子质量以17.0,水的密度以1.00g·cm-3计)
查看答案和解析>>
科目:
来源:新星高级中学2006-2007学年高三统一考试、化学专业试卷(一)(人教) 人教
题型:038
|
|
在25℃,101kPa条件下,将15LO2通入10LCO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强.
| (1) |
|
若剩余气体的体积是15L,则原CO和H2的混合气中V(CO)=________L,V(H2)=________L.
|
|
(2) |
|
若剩余气体的体积为aL,则原CO和H2的混合气中V(CO)∶V(H2)=________.
|
|
(3) |
|
若剩余气体的体积为aL,则a的取值范围是________.
|
|
|
查看答案和解析>>
科目:
来源:厦门双十中学2007届高三年级上学期半期考、化学试题
题型:038
钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的含钇矿石(YxeBe2Si2O10).现将4.68g矿样与过量的NaOH共熔,反应后加适量水溶解,过滤.滤渣中有Y(OH)3、Fe2O3(反应中Fe由+2价变为+3价),滤液中有Na2SiO3、Na2BeO2等.将滤液配成1L溶液,测知pH值为13(C(OH)=0.1mol/L),往此滤液中加入3.3mol/L盐酸100mL,结果pH值为1(C(H)=0.1mol/L),反应过程如图:
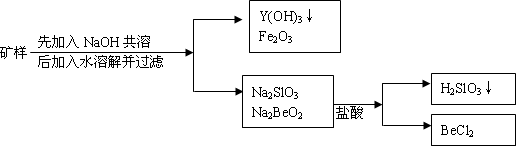
求Y元素的相对原子质量及X值.
查看答案和解析>>
科目:
来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷
题型:038
|
|
工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,控制一定条件,仅使Fe3+、Cr3+转化为沉淀,使废水中的铬含量达排放标准.现有1L含有Cr2O72-的酸性工业废水,用上述方法处理后,在阴极上得到0.896L(标准状况)气体,生成4.24g沉淀.
| (1) |
|
Cr2O72-在酸性条件下与Fe2+发生氧化还原反应,生成Cr3+和Fe3+.写出该氧化还原反应的离子方程式________.
|
|
(2) |
|
通过计算,确定处理后的废水中是否存在Cr2O72-.
|
|
(3) |
|
|
查看答案和解析>>
科目:
来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷
题型:038
|
|
合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的.造气的主要反应为:①2C+O2==2CO;②C+H2O(g)==CO+H2.
| (1) |
|
1200g焦炭按①、②式完全反应时,生成标准状况下气体的体积V的范围________m3.
|
|
(2) |
|
现将焦炭、H2O(g)和空气混合完全反应,使生成的混合气体中[n(CO)+n(H2)]/n(N2)=3,则混合气体中空气和H2O(g)的体积比为________(设空气中N2和O2的体积比为4∶1).
|
|
(3) |
|
为满足合成氨原料气的要求,使[n(CO)+n(H2)]/n(N2)=3,且n(N2)/n(H2)=1,工业上采用焦炭与富氧空气和H2O(g)同时反应,则该富氧空气中O2的体积分数为多少?(假设某富氧空气仍只含O2和N2)
|
|
|
查看答案和解析>>
科目:
来源:天佑中学2007届高考复习单元过关《碱金属、物质的量》试卷、化学
题型:038
|
|
某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为45.3g的该结晶水合物,分别制成溶液.向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失.另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g.
请回答以下问题:
| (1) |
|
该结晶水合物中含有的两种阳离子是________和________,阴离子是________.
|
|
(2) |
|
试通过计算确定该结晶水合物的化学式.________.
|
|
(3) |
|
假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图.
|
|
|
查看答案和解析>>
科目:
来源:宿迁市2007届高三第一次教学调查情况考试、化学
题型:038
|
|
有人在古玩市场买了个元宝,专家鉴定认为是由铜和银的合金制造的,为了测出该合金中银的质量分数,专家将30.0g该合金溶于80mL13.5mol/L的浓硝酸中,合金完全溶解后,收集到气体6.72L(标准状况),并测得溶液的c(H+)=1.0mol/L.假设反应后溶液体积不变,试计算:
| (1) |
|
(2) |
|
|
查看答案和解析>>
科目:
来源:宿迁市2007届高三第一次教学调查情况考试、化学
题型:038
|
|
一含有两种阳离子和一种阴离子的结晶水合物,现称取两份质量均为1.96g的该结晶水合物,配制成溶液.一份加入10mL0.1mol/LKMnO4的酸性溶液,MnO4—恰好完全被还原为Mn2+.另一份加入足量的Ba(OH)2溶液,生成白色沉淀,随即沉淀转变为灰绿色,最后变为红褐色;加热该混合物,逸出气体能无色酚酞试液变红;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33g.请回答以下问题:
| (1) |
|
该结晶水合物中含有的两种阳离子是________和________,阴离子是________.
|
|
(2) |
|
|
查看答案和解析>>
科目:
来源:四川郫县一中2006-2007上学期高三第一次月考、化学试题
题型:038
|
|
16.8g某单质A能从一定量盐酸中置换出0.6gH2,同时生成ACl2;另一种元素B,它的最高价氧化物的化学式BO3。在B的氢化物中,B的质量分数为94.1%。
| (1) |
|
计算A、B两种元素的相对原子质量,写出相应的元素符号。
|
|
(2) |
|
写出A、B反应的化学方程式,标出反应中电子转移的情况,指出氧化剂和还原剂。
|
|
|
查看答案和解析>>

