
科目: 来源:湖南省师大附中2006-2007学年度高三年级月考(六)化学试题 题型:038
A是由C、H或C、H、O元素组成的有机物,取0.1 mol A在6.72 L(标准状况,过量)氧气中燃烧,燃烧后的产物通过足量浓硫酸,浓硫酸增重3.6 g,在通过浓硫酸后的气体中点燃Mg条(足量),生成总质量为26.4 g的黑、白两种物质,且黑色生成物与白色生成物的质量比为1∶10.求:
(1)A的分子式.
(2)写出属于不同类别两种有机物A的结构简式.
查看答案和解析>>
科目: 来源:2007年无锡市秋学期高三期末调研试卷化学-旧人教 题型:038
| |||||||||||||||
查看答案和解析>>
科目: 来源:2007年无锡市秋学期高三期末调研试卷化学-旧人教 题型:038
取19.80 g MgCl2和CaCl2的混合物溶于水,加入210.00 mL 2 mol·L-1 AgNO3溶液,充分反应后过滤,在滤液中加入质量为10.00 g的铜片,充分反应后取出铜片,经洗涤干燥后称得质量为11.52 g.求原混合物中CaCl2的质量分数.
查看答案和解析>>
科目: 来源:2007年1月江苏省如皋中学高三化学期末综合练习-新人教 题型:038
实验室定量分析某样品中亚硫酸钠的一种方法是:
①在1.520 g样品中加入碳酸氢钾溶液、0.13% I2的氯仿溶液,在分液漏斗中振荡15 min.离子方程式为:
SO32-+I2+2HCO3-=SO42-+2I-+2CO2↑+H2O.
②取①中所得的水溶液,加入一定量乙酸、足量的饱和溴水溶液,充分振荡,其中碘离子被氧化成碘酸根离子,得到250 mL溶液.
③在②所得溶液中取25 mL,滴加甲酸,除去其中过量的Br2.
方程式为:Br2+HCOOH=2HBr+CO2↑
④将③所得溶液中加适量的醋酸钠,再加入足量的碘化钾溶液,振荡溶液.
⑤用标准的硫代硫酸钠溶液滴定④中所得溶液,共消耗0.1120 mol/L Na2S2O3 15.10 mL.离子方程式为:I2+2S2O32-=2I-+S4O62-.回答下列问题:
(1)写出②、④两步操作中所发生反应的离子方程式.
(2)①中为什么要用0.13% I2的氯仿溶液,而不直接用I2的水溶液?
(3)计算样品中亚硫酸钠的质量百分含量.
查看答案和解析>>
科目: 来源:2007高三化学高考冲刺模拟(13) 题型:038
A、B是下列浓度均为0.1 mol/L的溶液中的某一种:①混有少量盐酸的MgSO4溶液;②A12(SO4)3溶液;③明矾溶液;④Ba(OH)2溶液;⑤NaOH溶液.现向溶液A中逐滴加入溶液B,用得到的沉淀质量(y)与所加B溶液的体积(z)的关系可画出如图所示的图形(未画完整).
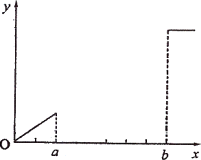
(1)符合这一图像的组合有很多组,如表中的②和④,④和③,请你将其他所有可能的组合填入下表中(已填了两组,不一定填满).
(2)若向试剂①中逐渐加入试剂④,请在图中画出生成的沉淀质量(y)与所加溶液体积(z)的关系曲线示意图.
查看答案和解析>>
科目: 来源:2007年江苏省前黄高级中学高三化学二模模拟试题 题型:038
钴(Co)化合物对化学键的研究起着重要的作用.为测定某钴化合物[Co(NH3)xCly]Clz的组成,进行如下实验:
称取样品0.5010 g,加入过量的NaOH溶液,煮沸,蒸出所有的氨,冷却,得到A.产生的氨用50.00 mL 0.5000 mol·L-1的盐酸完全吸收并用蒸馏水定容到100 mL,得溶液B,取B溶液20.00 mL,用0.1000 mol·L-1 NaOH滴定,消耗NaOH溶液30.00 mL.向A中加入过量的KI固体,振荡,盐酸酸化后置于暗处,发生反应:Com++I-→Co2++I2(未配平)反应完成后,蒸馏水稀释,用Na2S2O3溶液滴定析出的I2,消耗0.1000 mol·L-1 Na2S2O3溶液20.00 mL.反应方程式为:I2+2Na2S2O3=2NaI+Na2S4O6另称取该物质样品0.2505 g,溶于水,以0.1000 mol·L-1 AgNO3溶液滴定至恰好反应完全,消耗AgNO3溶液20.00 mL.相应反应式为:[Co(NH3)xCly]Clz+zAgNO3=[Co(NH3)xCly](NO3)z+zAgCl↓通过计算求:
⑴[Co(NH3)xCly]Clz中氮元素的质量分数.
⑵该钴化合物的化学式.
查看答案和解析>>
科目: 来源:2007年江苏省前黄高级中学高三化学二模模拟试题 题型:038
某资料说铁锈的成分为Fe2O3·H2O和FeCO3的混合物.根据此记载,某实验兴趣小组设计下列实验来验证其中是否含有碳酸亚铁.
①取一高度腐蚀的干燥铁钉,称其质量为10.04 g,在氮气保护下,充分加热,冷却后称得质量为8.92 g.
②将①得到的残渣投入到5.00 mol/L的硫酸中,不断添加硫酸直至残渣完全溶解时,恰好用去硫酸31.00 mL.整个过程无气体放出.试回答下列问题:
⑴铁锈中是否含有碳酸亚铁?理由是?
⑵锈蚀的铁钉中含Fe2O3·H2O多少克?
⑶锈蚀前铁钉的质量至少多少克?
查看答案和解析>>
科目: 来源:中学试卷网2007年高考化学大预测卷 题型:038
CO和CO2都可以合成甲醇:CO+2H2→CH3OH CO2+3H2→CH3OH+H2O
CO、CO2和H2可通过下列反应制备:
A:CH4+H2O(g)→CO+3H2 B:CO+H2O(g)→CO2+H2
反应A的产物合成甲醇时H2过量,反应B的产物合成甲醇时H2不足.为了充分利用原料可将两个反应的产物混合使用.
(1)反应A和反应B的产物气体混合的最佳比例(用同温同压下气体体积比表示)
(2)设取A的产物与B的产物混合气体67.2 L(标准状况),其中CO的体积分数为x,得到甲醇的物质的量y(纵坐标)随CO体积分数变化的函数关系式并作出图象(假定CO先与H2反应,CO完全反应后,CO2才与H2反应).
查看答案和解析>>
科目: 来源:如东县2007年高考化学模拟试题(一) 题型:038
将一块铜板浸泡在一定浓度的FeCl3溶液中一段时间后取出,得到一混合溶液,某校化学兴趣小组的同学为分析该混合溶液的组成,进行了如下实验:
Ⅰ、取50.0 mL混合溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为86.1 g;
Ⅱ、另取50.0 mL混合溶液,向其中加入1.40 g铁粉,结果铁粉全部溶解但未见固体析出;
Ⅲ、再取50.0 mL混合溶液,向其中加入20.0 mL稀硝酸,到一种无色气体,其体积换算成标准状况时为0.448 L;
请根据以上实验中得到的数据分析计算:
(1)原FeCl3溶液物质的量浓度(反应过程中过程中溶液体积的变化忽略不计);
(2)所得混合溶液中c(Cu2+)的取值范围;
(3)若要进一步求得混合溶液中c(Cu2+)的具体数值,在只单独使用AgNO3溶液、铁粉或稀硝酸的前题下,还可测出哪些数据,必须进行哪些实验?
查看答案和解析>>
科目: 来源:启东市汇龙中学迎二模模拟考试(二)、化学 题型:038
| |||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com