
科目: 来源:陕西省交大附中2012届高三第三次诊断化学试题 题型:038
向Fe3O4和 Fe的固体混合物6.88 g中加入50 ml 2 mol·L-1 H2SO4,恰好使固体完全溶解,并放出一定量气体.在所得溶液中加入KSCN溶液,溶液不变红色.
(1)写出Fe3O4和稀H2SO4反应的化学方程式________.
(2)混合物中Fe3O4和Fe的物质的量(写出计算过程).
(3)求反应中产生的气体在标准状况下的体积.(写出计算过程).
(4)若用足量的CO在高温下与相同质量的上述固体混合物反应,求最终能得到铁的质量.(写出计算过程).
查看答案和解析>>
科目: 来源:浙江省余姚中学2012届高三第一次质检化学试题 题型:038
将10 g铁粉置于40 mL HNO3溶液中,微热,反应过程中随着硝酸浓度的降低,生成气体的颜色由红棕色逐渐变为无色,充分反应后共收集到1.792 L标准状况下的混合气体(NO2、NO),溶液里还残留4.4 g固体.
(1)求该反应中被还原的硝酸与未被还原的硝酸的质量比.
(2)求理论上原硝酸的物质的量浓度.
(3)求混合气体中NO2、NO的体积比.
(4)写出上述反应的总的化学方程式.
查看答案和解析>>
科目: 来源:辽宁省抚顺二中2012届高三第一次月考化学试题 题型:038
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量.回答下列问题:
________H++________MnO4+________H2C2O4→________CO2↑+________Mn2++________□
(1)配平以上离子方程式,并在□中填上所需的微粒.
(2)该反应中的还原剂是________.
(3)反应转移了0.4 mol电子,则消耗KMnO4的物质的量为________mol.
(4)测定血钙的含量的方法是:取2 mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定.
①稀硫酸溶解CaC2O4沉淀的化学方程式是________.
②溶解沉淀时________(能或不能)用稀盐酸,原因是________.
③若消耗了1.0×10-4 mol/L的KMnO4溶液20.00 mL,则100 mL该血液中含钙________g.
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试海南卷化学 题型:038
PCl5的热分解反应如下:PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0 L的密闭容器中充入2.00 mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150 mol/L.计算该温度下的平衡常数.
查看答案和解析>>
科目: 来源:2007年普通高等学校招生全国统一考试海南卷化学 题型:038
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%.
(1)X的分子式是________;
(2)X与金属钠反应放出氢气,反应的化学方程式是________(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是________;
(4)X与高锰酸钾酸性溶液反应可生成Z.在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 gX和120 gZ反应能生成106 gW,计算该反应的产率.(要求写出计算过程)
查看答案和解析>>
科目: 来源:山东省青州一中2012届高三化学一轮跟踪训练:第8章 第4讲 沉淀溶解平衡(鲁科版) 鲁科版 题型:038
已知Ksp(AgCl)=1.8×10-10(mol/L)2,Ksp(Ag2CrO4)=1.9×10-12(mol/L)3,现在向0.001 mol/L K2CrO4和0.01 mol/L KCl混合液中滴加0.01 mol/L AgNO3溶液,通过计算
回答:
(1)Cl-、CrO![]() 谁先沉淀?
谁先沉淀?
(2)刚出现Ag2CrO4沉淀时,溶液中Cl-浓度是多少?(设混合溶液在反应中体积不变)
查看答案和解析>>
科目: 来源:山东省青州一中2012届高三化学一轮跟踪训练:第8章 第2讲 水溶液 酸碱中和滴定(鲁科版) 鲁科版 题型:038
25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH一样的定义来规定其酸碱度:pD=-lg[D+].
(1)写出重水的电离方程式.
(2)求25℃时,重水中各种离子的物质的量浓度.
(3)求25℃时,重水的pD.
查看答案和解析>>
科目: 来源:山东省青州一中2012届高三化学一轮跟踪训练:第7章第2讲化学反应的方向和限度(鲁科版) 题型:038
850℃时,一氧化碳与水反应,达平衡时平衡常数为1,计算Ⅰ和Ⅱ两种情况时CO的转化率之比.

查看答案和解析>>
科目: 来源:黑龙江省伊春市马永顺中学2012届高三11月月考化学试题(人教版) 题型:038
现有铁和铜组成的合金共a mol,其中铜的物质的量分数为x.将此合金研成粉末状后全部投入含b mol硝酸的稀溶液中,微热使其充分反应,硝酸的还原产物只有NO.
(1)用粒子符号填写下列空白(列举出全部可能出现的情况):
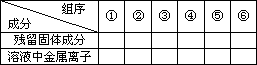
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围为(用a、x表示)
(3)当x=0.5时,溶液中Fe3+和Fe2+的物质的量相等,在标准状况下共生成672毫升NO气体,求a和b的值.
查看答案和解析>>
科目: 来源:江苏省泰州中学2012届高三上学期期中考试化学试题(人教版) 题型:038
Ba2+是一种重金属离子,有一环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.
(1)现需配制250 mL 0.100 mol·L-1的标准Na2S2O3溶液,所需要的玻璃仪器除量筒、烧杯、玻璃棒外,还需要________.
(2)配制上述溶液需准确称取Na2S2O3固体的质量为________g.
(3)另取废水40.00 mL,控制适当的酸度,加入足量的K2Cr2O7溶液,得BaCrO4沉淀,沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO![]() 全部转化为Cr2O
全部转化为Cr2O![]() ;再加入过量KI溶液进行反应,然后在反应溶液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液24.00 mL.已知有关反应的离子方程式为:
;再加入过量KI溶液进行反应,然后在反应溶液中再滴加上述Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液24.00 mL.已知有关反应的离子方程式为:
①Cr2O![]() +6I-+14H+
+6I-+14H+![]() 2Cr3++3I2+7H2O;
2Cr3++3I2+7H2O;
②I2+2S2O![]()
![]() 2I-+S4O
2I-+S4O![]() .
.
试计算该工厂废水中Ba2+的物质的量浓度为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com