
科目: 来源:上海市徐汇区2013年高考一模试卷化学试题 题型:038
下图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的![]() ,随着CO2的继续通入,活塞又逐渐向右移动.(不考虑活塞的磨擦)
,随着CO2的继续通入,活塞又逐渐向右移动.(不考虑活塞的磨擦)

已知:2Na2O2+2CO2→2Na2CO3+O2
1.已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g.
①此时,通入标准状况下的CO2气体多少L?
②容器甲中NO2转化为N2O4的转化率是多少?
③活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处.则a值必________0.01(填大于、小于、等于),其理由是________.
2.若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入的量CO2,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量最小值应大于________g.
查看答案和解析>>
科目: 来源:上海市普陀区2013年高考一模化学试题 题型:038
铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子).
根据题意完成:
1、为了制备铁氧体,称取5.6 g铁粉、一定量的FeCl3(s)作为原料,先制备Fe3O4.方法如下:用稀硫酸溶解铁粉,加入FeCl3(s),经过一系列反应得到纯净的Fe3O4[已知1 mol Fe(OH)2与2 mol Fe(OH)3混合灼烧可得到1 mol Fe3O4].需要加入FeCl3(s)________ g.
2、如果以MgSO4(s)和FeCl3(s)为原料制备9.0 g MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH(aq)________ mL.
3、在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品.取a克该产品溶于100 mL盐酸(足量)中,需要通入672 mL(标准状况)Cl2才能把溶液中的Fe2+全部氧化为Fe3+,然后蒸干所得溶液,灼烧至恒重,得9.6 g固体.计算:
(1)ag该产品溶于盐酸后,溶液中Fe2+的物质的量浓度(溶液体积变化忽略不计).
(2)推算该产品的化学式(写出推算过程).
4、有一种在电子工业广泛应用的含铬铁氧体,其组成可表示为:Fe2+·Fe3+[Fe3+(1-x)·Cr3+x·O4].向含有1.92 mol硝酸的某溶液中加入一定量的该种铁氧体,恰好完全反应后,收集到NO、NO2的混合气体2.688 L(标准状况).计算:(均需写出计算过程)
(1)参加反应的铁氧体的物质的量.
(2)所得气体中NO、NO2的体积比.
查看答案和解析>>
科目: 来源:2006年普通高等学校招生全国统一考试上海卷化学 题型:038
已知:4NH3+5O2![]() 4NO+6H2O;4NO+3O2+2H2O
4NO+6H2O;4NO+3O2+2H2O![]() 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)amol NO完全转化为HNO3需要氧气________mol;
(2)为使NH3恰好完全氧化为一氧化氮,氨-空气混合物中氨的体积分数为________(保留2位小数).
(3)20.0 moL的NH3用空气氧化,产生混合物的组成为:NO 18.0 mol、O2 12.0 mol、N2 150.0 mol和一定量的硝酸,以及其它成分.(高温下NO和O2不反应)
计算氨转化为NO和HNO3的转化率.
(4)20.0 moL的NH3和一定量空气充分反应后,再转化为HNO3.
①在下图中画出HNO3的物质的量n(A)和空气的物质的量n(B)关系的理论曲线.
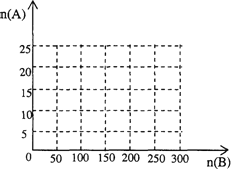
②写出当125≤n(B)≤200时,n(A)和n(B)的关系式________.
查看答案和解析>>
科目: 来源:山东省青州一中2012届高三化学一轮跟踪训练:第7章第2讲化学反应的方向和限度(鲁科版) 题型:038
将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2![]() 2SO3(正反应放热).反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)
2SO3(正反应放热).反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积).(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是________.(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是________.(填字母)
a.向装置中再充入N2
b.向装置中再充入O2
c.改变反应的催化剂
d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示).
(4)若将平衡时混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
查看答案和解析>>
科目: 来源:2011年全国普通高等学校招生统一考试化学试题上海卷 题型:038
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式.
该氢化物受撞击则完全分解为氮气和氢气.4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L.
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水.
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量.
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+4NH3 5N2+6H2O
5N2+6H2O
6NO2+8NH3 7N2+12H2O
7N2+12H2O
NO与NO2混合气体180 mol被8.90×103 g氨水(质量分数0.300)完全吸收,产生156 mol氮气.吸收后氨水密度为0.980 g/cm3.
计算:①该混合气体中NO与NO2的体积比.
②吸收后氨水的物质的量浓度(答案保留1位小数).
(4)氨和二氧化碳反应可生成尿素CO(NH2)2.尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物.测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比.
查看答案和解析>>
科目: 来源:上海市金山区2011届高三一模化学试题 题型:038
氧化铜、氧化亚铜都可作为玻璃或瓷器着色剂.
已知:
4CuO![]() 2Cu2O+O2↑
2Cu2O+O2↑
2Cu2O![]() 4Cu+O2↑
4Cu+O2↑
Cu2O+H2SO4→CuSO4+Cu+H2O
(1)称取8.00克CuO在1026℃左右加热一段时间,部分分解后,测知混合物中,n(CuO)∶n(Cu2O)=1∶2,则生成Cu2O的物质的量为________mol.
(2)将上述(1)得到的混合物继续加热到1800℃左右,发现有Cu生成,测知混合物中,n(CuO)∶n(Cu2O)∶n(Cu)=1∶2∶5,则两次加热共生成氧气的质量为________g.
(3)另取8.00克CuO,通入一定量氢气,加热,使氧化铜部分还原为Cu和Cu2O,测知反应混合物中n(Cu2O)∶n(Cu)=x,然后将混合物溶解于足量稀硫酸中,过滤,得到铜y g,试求未被还原CuO的物质的量(用x、y代数式表示).
查看答案和解析>>
科目: 来源:上海市吴淞中学2011届高三上学期第一次月考化学试题 题型:038
设空气中N2、O2的体积分数分别为0.8和0.2.在沸腾炉中将硫铁矿用空气充分煅烧:
4FeS2+11O2→2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过________%(保留一位小数).
(2)在实际生产中,接触室SO2与O2的体积比以1∶4较为适合.若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8∶1∶48,其流速为2.5 m3/s,则再往接触室里通入的空气的流速应该为________m3/s(保留一位小数,气体体积在同温同压下测定).
(3)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5∶1∶20:x,则x=________,此时反应中SO2的转化率为________%(保留一位小数).
(4)硫酸厂常用氨水吸收尾气的SO2、SO3等,再向吸收液中加入浓硫酸,以制取高浓度的SO2和(NH4)2SO4、NH4HSO4固体.为了测定上述(NH4)2SO4、NH4HSO4固体混合物的组成,现称取该样品四份[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],实验数据如下:(气体均在标况下测定)

①该混合物中(NH4)2SO4和NH4HSO4的物质的量之比________
②所用NaOH溶液的物质的量浓度.
查看答案和解析>>
科目: 来源:上海市虹口区2010届高三第二次模拟考试化学试题 题型:038
某化肥厂氨和空气(设氧气的体积分数为0.2,空气式量为29)生产硝酸铵过程如下:

其中①、②的反应方程式为:4NH3+5O2![]() 4NO+6H2O,4NO+3O2+2H2O→4HNO3
4NO+6H2O,4NO+3O2+2H2O→4HNO3
(1)若原料气的密度为1.25 g/L(标准状况),则氨气与空气的体积比________.
(2)若生产硝酸的氨气与空气中的氧气恰好完全反应,且硝酸全部溶解反应产生的水中,所得硝酸溶液的物质的量浓度为________(保留2位小数,此时硝酸溶液的密度为1.38 g/cm3).
(3)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨气(包含第③步被硝酸吸收的氨气)的体积分数最大值为________.
(4)若实际生产中,反应①的转化率为94%,反应②的转化率为97%,反应③中氨的转化率为98%,硝酸完全转化.求(写出计算过程):
(ⅰ)100 m3(已折算到标准状况)氨气最多可生产硝酸铵的质量(kg).
(ⅱ)合成硝酸铵的整个流程中,氨的总转化率.
查看答案和解析>>
科目: 来源:湖南省衡阳八中2010届高三第四次月考、化学试卷 题型:038
有一硫酸与硝酸的混合溶液,取10 mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到4.66 g的沉淀;滤液与2.0 mol·L-1 NaOH溶液反应,用去25 mL碱液时恰好完全中和.试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10 mL原混合液,加入3.2 g铜粉共热时,在标准状况下收集到气体的体积为多少毫升?
查看答案和解析>>
科目: 来源:湖南省西南名校联盟2009届高三下学期2月联合考试化学试题 题型:038
钢铁工业是国家工业的基础.铁及铁的化合物应用广泛,如钢铁用于建筑机械等,FeCl3可用于催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)钢铁吸氧腐蚀正极反应为________;
(2)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式________.
(3)腐蚀铜板后的混合溶液中,若要除去Cu2+中的Fe3+和Fe2+,请参照下表给出的数据和药品,除去CuCl2溶液中Fe3+和Fe2+的实验步骤 是①用试剂X将Fe2+氧化成Fe3;②加入CuO调节溶液的pH至3.2~4.7;③过滤除去Fe(OH)3.
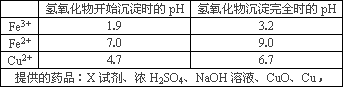
X试剂可以是( )
A.氯气 B.双氧水 C.高锰酸钾 D.次氯酸钠
(4)取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况).
①计算此钢样粉末中铁和碳的物质的量之比.
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
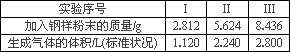
计算硫酸溶液的物质的量浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com