
科目: 来源:上海市长宁区2013年高考一模化学试题 题型:043
某化合物A经碱性水解后得到B,酸化后得到C(C8H8O2).核磁共振氢谱表明,C含有苯环,且苯环上有2种氢原子.B经过下列各步反应后得到G(C8H12O4),核磁共振氢谱显示G中只有1种氢原子.
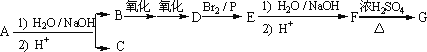
已知∶![]()
请回答下列问题∶
1.有机物类别∶A物质属于________类,C物质属于________类
2.写出满足下列条件的C的所有同分异构体∶________.
①是苯的对位二取代化合物;
②能与FeCl3溶液发生显色反应;
③不考虑烯醇(![]() )结构.
)结构.
3.写出F→G反应的化学方程式∶________.
4.写出A的结构简式∶
5.在G的粗产物中,经检测含有聚合物杂质.写出聚合物杂质可能的结构简式(仅要求写出1种)∶________.
查看答案和解析>>
科目: 来源:上海市奉贤区2012届高三4月调研考试(二模)化学试题 题型:043
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:043
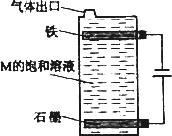
甲、乙、丙、丁、戊为原子序数依次增大的短周期元素.甲、丙处于同一主族,丙、丁、戊处于同一周期,戊原子的最外层电子数是甲、乙、丙原子最外层电子数之和.甲、乙组成的成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,0.1 mol/L的Y溶液pH>1;丁的单质既能与丙元素最高价氧化物的水化物的溶液反应生成盐L也能与Z的水溶液反应生成盐;丙、戊可组成化合物M.
请回答下列问题
(1)戊离子的结构示意图为________.
(2)与出乙的单质的电子式:________.
(3)戊的单质与X反应生成的Y和Z的物质的量之比为2∶4,反应中被氧化的物质与被还原的物质的物质的量之比为________.
(4)写出少量Z的稀溶液滴入过量L的稀溶液中发生反应的离子方程式:________.
(5)按下图电解M的饱和溶液,写出该电解池中发生反应的总反应方程式:________.将充分电解后所得溶液逐滴加入到酚酞试液中,观察到得现象是________.
查看答案和解析>>
科目: 来源:山东省青州一中2012届高三化学一轮跟踪训练:第8章 第2讲 水溶液 酸碱中和滴定(鲁科版) 鲁科版 题型:043
已知水在25℃和95℃时,其电离平衡曲线如下图所示:
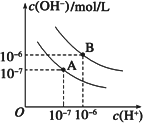
(1)则25℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由________.
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与pH=4的H2SO4溶液的体积比为________.
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________.
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析其原因:________.
查看答案和解析>>
科目: 来源:2010年普通高等学校招生全国统一考试、化学(江苏卷) 题型:043
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备.
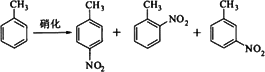
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1 h.反应结束后,过滤,滤液分别用5%NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯.
(l)上述实验中过滤的目的是________.
(2)滤液在分液漏斗中洗涤静置后,有机层处于________层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有________.
(3)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果.
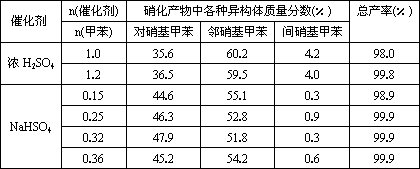
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为________.
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是________.
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有________、________.
查看答案和解析>>
科目: 来源:黑龙江哈尔滨九中2009届高三上学期第五次月考化学试题 题型:043
某含碳氢氧三种元素的有机物HMPA,其分子式可表示为CxHyO3,该有机物碳与氢两元素的质量分数之和等于氧元素的质量分数的两倍.根据下列转化关系回答问题:(已知:同一个碳原子不能连接两个羟基)
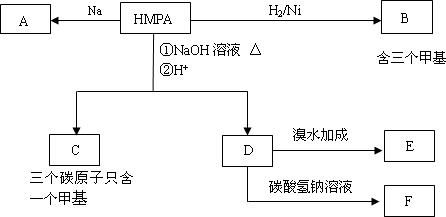
1)、HMPA的相对分子质量________;分子式为________.
2)、C的结构简式________.
3)、D与溴水反应的化学方程式为________.
4)、与D互为同分异构体,同时满足下列要求的结构有________种.
①不与金属钠反应 ②含有![]() 结构 ③不含任何环状结构.
结构 ③不含任何环状结构.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-铁铜及其化合物(1) 题型:043
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体.生产过程如下:
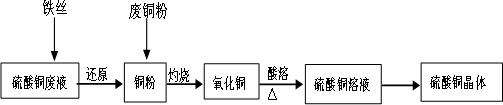
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有______________.
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物.原因是:
①灼烧不充分Cu未被完全氧化.
②CuO被还原.还原剂是________,该还原反应的化学方程式是________.
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2.通入O2的目的是(用化学反应方程式表示)________.
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是________.
查看答案和解析>>
科目: 来源:安徽省蚌埠二中2009届高三12月月考化学试题人教版 题型:043
材料科学是近年来与化学有关的科学研究的热点,某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特性,它是以中学化学中的常见物质为原料来生产的,下图所示为其生产过程,其中虚线框内转化是为探究C的组成而设,G、F、H均难溶于水且为白色粉末;图中除M、K(均含A元素)外均为中学化学常见物质:

请回答下列问题:
(1)指出K可能所属的晶体类型________,K晶体中A原子周围化学键的键角均相等,键角值为________.
(2)写出化学式:单质B________;化合物F________;化合物C________.
(3)写出下列反应的离子方程式:
反应③________;
反应⑤________;
(4)写出反应④的化学方程式:________.
查看答案和解析>>
科目: 来源:2007年全国普通高校统一招生考试(山东卷)理科综合试测题化学部分 题型:043
燃料在电池中直接氧化而产生电能的装置叫燃料电池,它是一种高效低污染的新型电池.燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲醇、肼等.肼分子(H2N-NH2)可以在氧气中燃烧生成氮气和水,回答下列问题:
(1)
利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池反应的电极反应式和总反应式;并指出电解质溶液中,OH-离子向哪极移动;(2)肼在水中,通常结合一分子水,形成H2N-NH2·H2O,其一级电离与NH3·H2O的电离类似,H2N-NH2·H2O水溶液的碱性可以通过只考虑其一级电离求出,其一级电离的电离常数Kb=3.0×10-6,为了求浓度为0.1 mol/L肼溶液的OH-浓度,人们常将Kb=[H2N-NH3+]·[OH-]/[H2N-NH2·H2O]近似为Kb=[OH-]2/0.1,请给出理由.
(3)
肼是强还原剂,与氧化剂反应时放出大量的热,如:N2H4(l)
+2H2O2(l)=N2(g)+4H2O(g) ΔH=-642.2 kJ·mol-1,因此肼可以作为火箭推进剂.根据该反应,你认为是否可以通过改变反应条件,由N2和水来制取N2H4,若能指出可能的反应条件;若不能请指出原因.查看答案和解析>>
科目: 来源:上海市浦东新区2012届高三4月(二模)质量抽测化学试题 题型:043
异戊二烯(C5H8)是橡胶工业的重要原料.工业上有多种合成方法,其中两种如下:
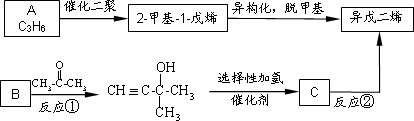
根据题意回答下列问题:
1.A的结构简式为________.已知B可作为生产高分子导电材料的原料,则B的名称是________.反应①的反应类型是________.
2.反应②的化学方程式为________.
3.丁基橡胶是由异戊二烯与2-甲基丙烯共聚生成,写出该橡胶的结构简式________.
4.与异戊二烯相差一个“CH2”原子团,且结构中只有一个甲基的同系物除CH2=CH-CH2-CH=CH-CH2
、CH2=CH-CH=CH-CH2-CH3、![]() 外,还有________(填结构简式)(已知
外,还有________(填结构简式)(已知![]() 不稳定).
不稳定).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com