
科目: 来源:2006年北京四中高考最后押题(化学学科) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:058
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了I和II两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去)用以制取NO2并验证NO2能否支持木条燃烧.
(一)实验分组进行(步骤略):
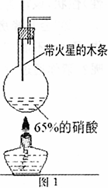
I.实验装置如图1所示
(1)写出浓硝酸受热分解的化学方程式:________;
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论.你认为这一结论是否正确?________(填“正确”或“不正确”),理由是________.
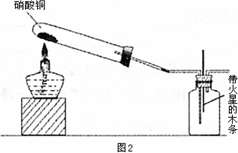
II.实验装置如图2所示:
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,试写出该反应的化学方程式:________;
(2)当集气瓶中充满红棕色气体时,余烬木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论.你认为这一结论是否正确?________(填“正确”或“不正确”),理由是________;
(二)(1)上述两种实验装置都存在的缺陷为________,在进行实验时,造成的不良后果是________.
(2)为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作步骤.
查看答案和解析>>
科目: 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:058
某校化学小组学生进行如下实验.
(1)使用铜和稀硫酸制备硫酸铜晶体.步骤如下∶
步骤①观察到的现象是________.步骤③的主要操作包括∶________.
(2)硫酸铜溶解度的测定.
用石墨电极(相同)电解饱和CuSO4溶液,阴极的电极反应式是________.已知饱和CuSO4溶液的质量为60 g,通电10 min后,溶液恰好变为无色.称量发现两电极质量差为4 g,此温度下CuSO4的溶解度是________.
(3)某同学查询资料得知∶铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2,铜屑可逐渐溶解.实验小组同学设计实验装置如图,验证该实验,该反应的化学方程式是________.若将H2O2和稀硫酸加入烧瓶中的顺序颠倒,实验得到的结论是________.

查看答案和解析>>
科目: 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2006年高考化学临考模拟调试题(浙江省金华市汤溪中学) 题型:058
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:山东省青州一中2012届高三化学一轮跟踪训练:第8章 第3讲 盐类的水解(鲁科版) 鲁科版 题型:058
限使用下列试剂:酚酞、石蕊、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水.根据:①弱碱在水中存在电离平衡;②弱碱的阳离子会破坏水的电离平衡.这两种平衡的移动均会引起指示剂颜色的变化.由此可分别选用上述试剂,设计两种实验证明NH3·H2O是弱碱,请简述实验方法及现象.
(1)应用根据①的实验方法及现象:________.
(2)应用根据②的实验方法及现象________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com