相关习题
0 95701 95709 95715 95719 95725 95727 95731 95737 95739 95745 95751 95755 95757 95761 95767 95769 95775 95779 95781 95785 95787 95791 95793 95795 95796 95797 95799 95800 95801 95803 95805 95809 95811 95815 95817 95821 95827 95829 95835 95839 95841 95845 95851 95857 95859 95865 95869 95871 95877 95881 95887 95895 203614
科目:
来源:广东省广州市执信中学2006-2007高考化学十一月模拟题
题型:058
|
|
用下图所示装置进行实验,将A逐滴加入B中:
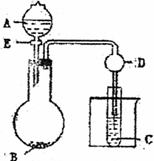
| (1) |
|
若A为浓H2SO4,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是________(化学式),B与浓H2SO4反应的方学方程式为________;反应后往烧杯中加入沸水,又可观察到试管C中的现象为________.
|
|
(2) |
|
若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是________.然后往烧杯中加入沸水,可观察到试管C中的现象是________.
|
|
(3) |
|
若B是生石灰、实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是________(名称),C是________与葡萄糖的混合液,仪器D在此实验中的作用是________.
|
|
|
查看答案和解析>>
科目:
来源:广东佛山南海中学2006-2007学年度高三摸底测试、(化学试卷)
题型:058
|
|
某种含有少量氧化钠的过氧化钠试样(试样质量为1.560g、锥形瓶和水的质量
190.720g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天
平的数据如表:
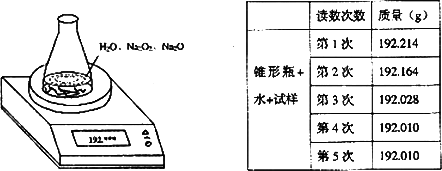
| (1) |
|
写出Na2O2和H2O反应的化学方程式________
|
|
(2) |
|
计算过氧化钠质量分数时,必需的数据是________不必作第6次读数的原因是________
|
|
(3) |
|
测定上述样品(1.560g)中Na2O2质量分数的另一种方案,其操作流程如下:
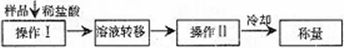
①操作Ⅱ的名称是________
②需直接测定的物理量是________
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要________、________(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果________(填偏大、偏小或不变).
|
|
|
查看答案和解析>>
科目:
来源:广东佛山南海中学2006-2007学年度高三摸底测试、(化学试卷)
题型:058
|
|
维生素C(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化.新鲜水果、蔬菜、乳制品中都富含维生素C.如新鲜橙汁中维生素C的含量在500mg/L左右.某课外小组利用碘滴定法测某橙汁中维生素C的含量,
其反应原理为:
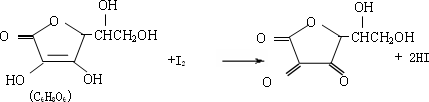
| (1) |
|
下列说法中正确的是
|
A. |
上述反应为取代反应
|
B. |
滴定时可用淀粉溶液作指示剂
|
C. |
滴定时可用甲基橙作指示剂
|
D. |
锥形瓶不能用待测橙汁润洗.
|
|
(2) |
|
上述实验前要配制7.50×10-3mol/L的标准碘溶液100mL.除玻璃棒外,还需要的玻璃仪器有________等(填编号)
|
A. |
容量瓶
|
B. |
烧杯
|
C. |
锥形瓶
|
D. |
烧瓶
|
|
(3) |
|
标准碘液放入________(填仪器名称),滴定时,眼睛注视________,直到滴定终点.滴定至终点的现象是________.
|
|
(4) |
|
滴定过程中能否剧烈摇动锥形瓶________(填能或不能).为什么________.
|
|
(5) |
|
若经数据处理,滴定中消耗的标准碘溶液的体积是15.00mL,锥形瓶中注入的待测橙汁是20.00mL,则此橙汁中维生素C的含量是________mg/L该橙汁________(填“是”或“不是)纯天然的新鲜橙汁
|
|
|
查看答案和解析>>
科目:
来源:广东番禺中学2007届高三化学第二次月考
题型:058
|
|
某中学有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20℃,1atm)下气体摩尔体积的方法.
| (1) |
|
甲组同学拟选用下列实验装置完成实验:

①该组同学必须选用的装置的连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满.)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶.请你帮助分析原因.________.
③实验结束时,该组同学应怎样测量实验中生成氢气的体积?________.
|
|
(2) |
|
乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小.于是他们设计了右图所示的实验装置.
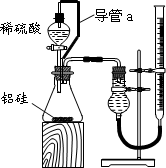
①装置中导管a的作用是________,________
②实验中准确测得4个数据:实验前铝硅合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL.则通常状况时气体摩尔体积Vm=________·moL-1.
|
|
|
查看答案和解析>>
科目:
来源:广东番禺中学2007届高三化学第二次月考
题型:058
|
|
电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
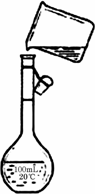
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶
物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
| (1) |
|
上述实验中的过滤操作需要烧杯、________、________等玻璃仪器.
|
|
(2) |
|
步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:________;
|
|
(3) |
|
步聚2中,判断加入BaCl2已过量的方法是:________;
|
|
(4) |
|
步聚2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是:________;
|
|
(5) |
|
为检验精盐纯度,需配制150mL0.2mol/LNaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是________、________.
|
|
|
查看答案和解析>>
科目:
来源:广东番禺中学2007届高三化学第二次月考
题型:058
|
|
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物.“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物.该药品不溶于水但能溶于人体中的胃酸.
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

| (1) |
|
试剂1是________,试剂2是________,加入新制氯水后溶液中发生的离子反应方程式是________,________;
|
|
(2) |
|
加入试剂2后溶液中颜色由淡黄色转变为淡红色的是因为________,请你运用物质结构的知识解释Fe3+比Fe2+稳定的原因________;
|
|
(3) |
|
该同学猜想血红色溶液变为无色溶液液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗?________.若你认为合理,请说明理由(若你认为不合理,该空不要作答)________;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答)________.
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:058
|
|
已知:KMnO4、MnO2在酸性条件下均能将草酸钠氧化,Mn元素均被还原为Mn2+.某研究小组为测定软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品置于一烧杯中,加入2.68g草酸钠固体,再加入过量的稀硫酸并加热(杂质不参加反应并且不溶于酸),充分反应后冷却、滤去杂质,将所得溶液全部转移到100mL容量瓶中并定容后备用;准确量取20.00mL0.0400mol·L-1的KMnO4标准溶液置于锥形瓶中,再从容量瓶中取出部分溶液置于一洁净且不漏水的滴定管中进行滴定,当滴入25.00mL待测液时恰好完全反应.请回答下列问题:
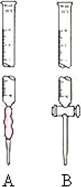
| (1) |
|
写出MnO2氧化草酸钠的离子方程式________;
|
|
(2) |
|
将MnO2氧化草酸钠后的溶液全部转移到100mL容量瓶中的具体操作是________;
|
|
(3) |
|
从容量瓶中取出的部分溶液应置于________(选填“A”或“B”)滴定管中;滴定前必须进行的操作是________,滴定过程中是否需要指示剂________(选填“是”或“否”),若回答“是”,请写出指示剂的名称;若回答“否”,请写出判断滴定终点的依据________;
|
|
(4) |
|
你能否帮助该研究小组求得软锰矿中MnO2的质量分数________(选填“能”或“否”),若回答“能”,请求出计算结果;若回答“否”,请说明原因________.
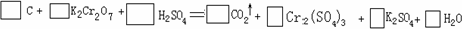
|
|
|
查看答案和解析>>
科目:
来源:广东东莞新星高级中学2006-2007学年高三统一考试、化学专业(3) 人教 人教
题型:058
|
|
某学生取纯净的Na2SO3·7H2O50.00g,在密闭容器中经6000C以上的强热至恒重,分析及计算表明,恒重后的样品质量相当于无水亚硫酸钠的计算值,而且各元素的组成也符合计算值,但将它溶于水,却发现溶液的碱性大大高于同时配制的亚酸钠溶液.经过他的实验和思考,这位同学解释了这种反常现象.
| (1) |
|
他将恒重后的样品溶于水配成溶液,为加速溶解,可采取________的措施,观察发现样品全部溶解,溶液澄清.
|
|
(2) |
|
取少量(1)中所配溶液,加入足量的用________(填一种酸)酸化的氯化钡溶液有白色沉淀,说明产物中含有________(填离子符号).
|
|
(3) |
|
另取少量(1)中所配溶液于试管中,滴加少量盐酸,看到气泡产生,通过________方法闻到臭鸡蛋气味,说明生成________气体,写出生成该气体的离子反应方程式:________;同时发现溶液变浑浊,原因是:(用离子方程式表示)________.
|
|
(4) |
|
根据以上实验,该同学经分析解释了以上实验中的反常现象,请你用一个化学方程式表示:________.这一反应在上述实验中________(填“是”或“否”)能确定反应完全.
|
|
|
查看答案和解析>>
科目:
来源:新星高级中学2006-2007学年高三统一考试、化学专业试卷(一)
题型:058
|
|
为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如右图所示的实验装置.实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶Ⅰ中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空.
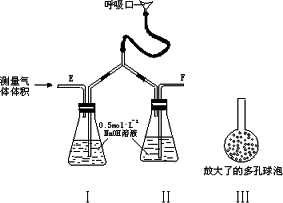
| (1) |
|
(2) |
|
对实验装置尚有如下A、B、C、D四种建议,你认为合理的是(填代号)________.
|
| [ ] |
A. |
在E处增加CaCl2干燥管
|
B. |
在F处增加CaCl2干燥管
|
C. |
在E和F两处增加CaCl2干燥管
|
D. |
不必增加干燥管
|
|
(3) |
|
将插入溶液的管子下端改成具有多孔的球泡(图中的Ⅲ),有利于提高实验的准确度,其理由是________.
|
|
(4) |
|
实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶Ⅰ溶液增重ag,收集到的气体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式):________.
|
|
(5) |
|
实验中若猛吸猛呼,会造成不安全后果,猛吸时会________,猛呼时会________.
|
|
|
查看答案和解析>>
科目:
来源:东莞市塘厦中学2007届高三月考(二)、九月月考化学试题(人教) 人教
题型:058
|
|
无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝试剂瓶久置潮湿空气中,会自动爆炸产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂等.
图5-45是实验室制取少量无水氯化铝装置的一部分,在方框中安装某些仪器,便是该装置的另一部分,从A口通入某种气体,即可制取无水氯化铝.现提供的试剂除装置中已有的铝粉和碱石灰外,还有NaCl固体、MnO2、浓H2SO4和水,而提供的安装方框中装置的仪器不限,用上述方法制取无水氯化铝,请回答下列问题:

| (1) |
|
利用上述条件,可制取的气体有(填化学式)________;
|
|
(2) |
|
若要安全、顺利地制取无水氯化铝,通入A口的气体应是________;
|
|
(3) |
|
用中学化学实验室常用的方法制取通入A口的气体的反应方程式是________
|
|
(4) |
|
用(3)的方法制得的气体中可能还含有的气体有________,通入A口前是否有必要除去,不必除去或必须除去的原因是________;
|
|
(5) |
|
按(3)的方法安装方框图中的装置,所需要的玻璃仪器(同一种仪器,数量在2件或2件以上的要写明件数)有________;
|
|
(6) |
|
装置图中甲、乙两支干燥管中需要填充碱石灰的是(填甲或乙或甲、乙)________,甲的作用是________,乙的作用是________.
|
|
|
查看答案和解析>>
