
科目: 来源:江苏省盐城上冈高级中学2007高三第二次阶段考试、化学试题 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:江苏省盐城上冈高级中学2007高三第二次阶段考试、化学试题 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省苏州中学2006-2007学年度高三化学初考试卷 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省苏州中学2006-2007学年度高三化学初考试卷 题型:058
间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I?/SUP>作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-;析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32-+I3-S4O62-+3I-.
操作:准确称取ag胆矾试样(可能含少量Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液.
①实验中,在加KI前需加入少量NaF,推测其作用可能是________.
②实验中加入硫酸,你认为硫酸的作用是________.
③本实验中用碘量瓶而不用普通锥形瓶是因为:________.
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:________.
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=________.
查看答案和解析>>
科目: 来源:江苏省淮阴中学2007届高三第一次阶段检测、化学 题型:058
| |||||||||||
查看答案和解析>>
科目: 来源:江苏省淮安中学2007届高三化学第二次月考试卷 题型:058
将化学知识的系统化,有助于对化学问题的进一步认识.请你参与下列关于化学反应的讨论.
问题1:从不同的角度,化学反应可以有不同的分类方法.四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的.请在右图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系.

问题2:不同化学反应进行的快慢和程度千差万别.反应的快慢和程度是化工生产考虑的两个重要因素.请你按照表中要求完成下表(填写内容不能重复).

问题3:化学反应中均伴随着能量的变化.如果一个化学反应中,反应物的总能量和生成物的总能量有如图所示的关系,则该反应过程中的能量变化是________.
已知热化学方程式为:

C(g)+O2(g)=CO2(g)△H=—393.5KJ/mol
H2(g)+1/2O2(g)=H2O(l)△H=—285.8KJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是________(保留1位小数).
问题4:化学反应的发生是有条件的.反应物相同,反应的条件不同,反应的原理不同.如:4Na+O2=2Na2O2Na+O2![]() Na2O2;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,
Na2O2;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,
反应的原理不同:________.
查看答案和解析>>
科目: 来源:江苏省淮安中学2007届高三化学第二次月考试卷 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:江苏省淮安中学2007届高三化学第二次月考试卷 题型:058
在装修居室时,如使用不合格的建筑、装潢材料,易造成“室内空气污染”,影响人们身体健康,造成室内空气污染的有毒物质主要有甲醛、苯、氨、氡等.学好化学有助于我们设法减少居室内的空气污染,消除空气中的有害物质对人体可能产生的影响.回答下列问题:
我国《室内空气质量标准》规定室内空气中甲醛含量不得超过0.08mg/m3.小陈同学为测定新居内空气中甲醛含量是否超标,设计了如图所示的简易实验装置:
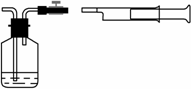
①请你帮助小陈同学选择装置中试剂瓶内的药品:________(填序号);
a.银氨溶液
b.酸性高锰酸钾溶液
c.新制得氢氧化铜悬浊液
根据你的选择,为使实验现象明显,你认为对所选择试剂的浓度有什么要求________;
②在检查好装置气密性和选择好试剂瓶内的药品后,请你帮助小陈同学完成该实验的操作:________;
③若试剂瓶内溶液的体积和浓度已知,实验时还需测定的数据有:
________、________;
查看答案和解析>>
科目: 来源:江苏省邗江中学2006~2007学年度第一学期高三化学期中试卷(旧人教) 旧人教 题型:058
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:华中师大第一附属中学2006-2007学年度部分学校高三化学起点调研测试卷 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com