相关习题
0 95710 95718 95724 95728 95734 95736 95740 95746 95748 95754 95760 95764 95766 95770 95776 95778 95784 95788 95790 95794 95796 95800 95802 95804 95805 95806 95808 95809 95810 95812 95814 95818 95820 95824 95826 95830 95836 95838 95844 95848 95850 95854 95860 95866 95868 95874 95878 95880 95886 95890 95896 95904 203614
科目:
来源:山东省淄博市2006-2007学年度高三摸底考试、化学
题型:058
|
|
某研究性学习小组为测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,设计了如下实验步骤:
①准确称量样品质量ag;
②向样品中加入10mL6mol·L—1的盐酸,样品溶解后再加入蒸馏水配成100mL溶液;
③向上述溶液中加入3mL氯水,搅拌使其反应完全;
④加入10%的氨水至过量,充分搅拌,使沉淀完全;
⑤过滤,将沉淀洗涤后干燥;
⑥将沉淀移至坩埚中,灼烧、冷却、称重,并反复操作多次至固体完全反应.
试回答下列问题:
| (1) |
|
写出步骤④中产生沉淀的离子方程式:________.
|
|
(2) |
|
(3) |
|
洗涤沉淀的操作方法是________;检验沉淀是否洗净的方法是________.
|
|
(4) |
|
在步骤⑥中,判断固体反应完全的方法是:________.
|
|
(5) |
|
若空坩埚质量为bg,充分灼烧固体完全反应后,剩余固体和坩埚的总质量为cg,则样品中铁元素的质量分数是________×100%
|
|
|
查看答案和解析>>
科目:
来源:山东省诸城市2006-2007学年度上学期高三年级期中考试、化学试题
题型:058
|
|
用如图所示装置进行下列实验.
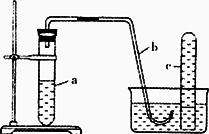
| (1) |
|
在检查装置所密性后,向试管a中加入10mL6mol·L-1稀硝酸和lg铜片,立即将带有导管的橡皮塞塞紧管口.请写出试管a中有可能发生的所有反应的化学方程式________.
|
|
(2) |
|
该实验刚开始速率缓慢,随后逐渐加快,这是由于________.
|
|
(3) |
|
为了使产生的气体不至于逸散到空气中,请写出向试管a中加入试剂的操作方法________.
|
|
(4) |
|
欲较快地制取NO,可采取的措施有(列举两种)________、________.
|
|
|
查看答案和解析>>
科目:
来源:山东省潍坊市2006-2007学年度第一学期高三年级教学质量检测、化学试题
题型:058
|
|
某同学在实验室制氨气时进行下列实验设计.
| (1) |
|
实验室制氨气的原理(写化学方程式):________,氨气的电子式为:________,氨气分子的空间构型是:________.
|
|
(2) |
|
实验室制氨气的发生装置与制________气体完全相同.(填化学式)
|
|
(3) |
|
将制备的氨经________干燥后,在催化氧化制硝酸时出现白烟,试解释:(用相关化学方程式表示)________.
|
|
|
查看答案和解析>>
科目:
来源:山东省胜利一中2006-2007学年度第一学期高三月考化学
题型:058
|
|
测定海水中溶解氧的步骤如下:
(1)水样的固定.取amL海水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,并振荡摇匀,使之充分反应.
(2)酸化.开塞后迅速加适量1:1的硫酸,再迅速塞好瓶塞.反复振荡至沉淀完全溶解.
(3)滴定.向溶液中加入1mL0.5%淀粉溶液,再用bmol/LNa2S2O3标准溶液滴定至溶液刚好褪色.有关的离子反应如下:
2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)
MnO(OH)2+2I-+4H+=Mn2++I2+3H2O
I2+2S2O32-=2I-+S4O62-
请回答下列问题:
| (1) |
|
在进行(1)、(2)操作时,要注意“迅速”,如果操作缓慢,会使测定结果________(填“偏高”或“偏低”或“无影响”)原因是________.
|
|
(2) |
|
滴定前,用蒸馏水洗净滴定管即加入Na2S2O3标准溶液,会使测定结果________(填“偏高”或“偏低”或“无影响”)原因是________.
|
|
(3) |
|
滴定前,未排除滴定管中的气泡.在滴定过程中气泡的排除,会使测定结果________(填“偏高”或“偏低”或“无影响”)原因是________.
|
|
(4) |
|
滴定时消耗VmLNa2S2O3标准溶液,则水中溶解O2(g/L)的量的计算式为________.
|
|
|
查看答案和解析>>
科目:
来源:山东省乳山市2006-2007学年度高三年级第一学期期中考试、化学试题
题型:058
|
|
某同学运用已有的Na2O2和CO2反应的知识进行迁移,认为Na2O2也可和SO2反应.为此设计了如下一套装置,来验证Na2O2和SO2反应的反应产物.

如图安装仪器,检查装置气密性后填加药品并滴入适量浓硫酸.回答下列问题:
| (1) |
|
点燃A处酒精灯,不久可观察到烧瓶中产生大量气体,写出反应的化学方程式:________;C处玻璃管管壁发热,管内药品的颜色变化是________.
|
|
(2) |
|
在反应过程中如何用较简便的操作证明反应产生了O2?________写出C管内反应的化学方程式,并标出电子转移的方向和数目:________.
|
|
(3) |
|
F处用排水法收集气体,从什么现象可证明收集的气体中已不含SO2?________.
|
|
(4) |
|
待反应结束后,取C玻璃管内的少量固体,装入试管中,加水溶解时未产生气体,则如何证明产物中有Na2SO3?________
|
|
(5) |
|
待反应结束后,取C玻璃管内的少量固体,装入试管中,加入足量的盐酸,再加入氯化钡溶液,发现有白色沉淀生成,试分析产生沉淀的原因:________
|
|
(6) |
|
有的同学认为:若将装置末端的烧杯换成量筒(或量气管),则可通过测定排水的体积来测定Na2O2药品的纯度.试判断该方案是否可行:________(填“是”、“否”)原因是________.
|
|
|
查看答案和解析>>
科目:
来源:山东省乳山市2006-2007学年度高三年级第一学期期中考试、化学试题
题型:058
|
|
电解原理在化学工业上有着广泛的应用,按下图所示装置进行电解实验:
A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入几滴酚酞试液.回答下列问题:

工作一段时间后,
| (1) |
|
A极附近可观察到的现象是________.检验B电极上反应产物的通常方法是________.
甲电池中电解反应的离子方程式是________;溶液中还可能存在的离子反应方程式是________
|
|
(2) |
|
甲槽溶液的Ph________;乙槽溶液的pH________(填“上升”、“下降”或“不变”).当A极上收集到22400mL气体(标准状况)时,乙装置的C极上可得到________g金属单质.
|
|
(3) |
|
A、D两极上析出的物质可以制成已在阿波罗飞船中使用的新型电源,其结构如右图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出而在电极表面放电.a是电源的________极,电极反应式为________.

|
|
|
查看答案和解析>>
科目:
来源:山东省聊城市2006-2007学年度第一学期高三年级期中考试、化学试题
题型:058
|
|
某化学课外小组所做实验的示意图如下:

上图中“→”表示所体流向,M是一种纯净而干燥的气体,Y为另一种气体,E内有棕色产生,实验所用的物质,只能由下列物质中选取:
Na2CO3、Na2O2、NaCl、Na2O、CaC12、(NH4)2CO3、碱石灰固体及蒸馏水,据此实验,完成下列填空:
| (1) |
|
(2) |
|
B中所选的干燥剂是________其作用是________
|
|
(3) |
|
(4) |
|
|
查看答案和解析>>
科目:
来源:山东省聊城市2006-2007学年度第一学期高三年级期中考试、化学试题
题型:058
|
|
实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
| (1) |
|
实验中除了烧杯、量筒外还需要的其它仪器有:________.
|
|
(2) |
|
根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸体积为________mL.(计算结果保留一位小数)
|
|
(3) |
|
配制一定物质的量浓度溶液的实验中,如果出现以下操作:
A、量取浓硫酸的量筒内有少量少;
B、浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中;
C、住容量瓶转移是,有少量液体溅出
D、将量筒洗涤后洗涤液一并转入容量瓶
E、容时仰视刻度线
F、量瓶未干燥即用来配制溶液
G、容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
对配制的溶液物质的量浓度大小可能造成的影响是(填写字母)
偏大的有________;无影响有________
|
|
|
查看答案和解析>>
科目:
来源:山东省济南市2006-2007学年度第一学期高三年级统一考试、化学试题
题型:058
|
|
某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究.
| (1) |
|
(2) |
|
设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比.

|
|
(3) |
|
查阅资料:氮气不与碳、氧化铁发生反应.实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气.请写出该反应的离子方程式:________.
|
|
(4) |
|
实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气.冷却至室温,称得硬质玻璃管和固体总质量为52.24g.
|
|
(5) |
|
数据处理,经计算,参加反应的碳元素质量为0.48g氧元素为0.96g.得出原假设不成立,理由是________.
|
|
(6) |
|
得出结论:根据数据处理结果判断反应产生的气体是________,该实验中发生的化学方程式为________.
|
|
(7) |
|
实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进?________.
|
|
|
查看答案和解析>>
科目:
来源:山东省菏泽一中2006-2007学年度高三第二次月考、化学试卷
题型:058
|
|
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验上学骤如下
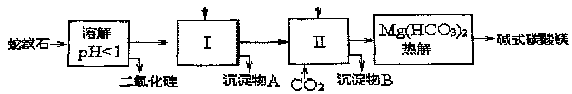
| (1) |
|
蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________.
|
|
(2) |
|
进行Ⅰ操作时,控制溶液pH=7-8
(有关氢氧化物沉淀的pH见下表)

Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解________沉淀.
|
|
(3) |
|
从沉淀混合物A中提取红色氧化物作颜料.先向沉淀物A中加入________填入物质的化学式),然后________(依次填写实验操作名称).
|
|
(4) |
|
物质循环使用,能节约资源.上述实验中,可以特环使用的物质是________(填写物质化学式).
|
|
(5) |
|
现设计一个实验,确定新产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量②高温分解③________④________⑤MgO称量
|
|
(6) |
|
18.2g产品完全分解后,产生6.6gCO2和8.0gMO由此可知,产品的化学式中:
a=________b=________c=________
|
|
|
查看答案和解析>>
