
科目: 来源:增城市2007届高三毕业班综合测试化学试题 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:增城市2007届高三毕业班综合测试化学试题 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:058
在一次学生实验中,学生用带有氧化膜的铝片和稀硫酸反应,发现铝片和稀盐酸、稀硫酸反应发现铝片和稀盐酸反应现象明显,而和稀硫酸几乎不反应.这和“铝能跟稀盐酸或稀硫酸反应生成氢气”不一致,是什么原因呢?是试剂、药品出了问题吗?为了寻找原因,某学生在教师的指导重新用浓盐酸配制了一定浓度的溶液,然后加入0.1×10×10mm3,纯度≥99.5%的铝片验证是否确实存在上述现象,实验结果如下表
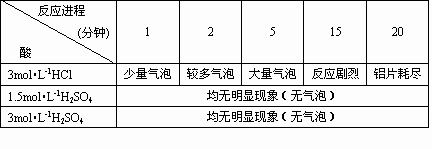
无论是用1.5mol昄-1H2SO4还是用3mol昄-1H2SO4,均无明显现象.其结论还是与“铝能跟稀硫酸或稀盐酸反应生成氢气”不相符合.
问题1:为了探索“铝与稀盐酸和稀硫酸反应的差异原因”,你能对问题的答案作出哪些假设或猜想:
假设一:________
假设二:________……
问题二:为了论证上述假设,你设计的实验方案是:(探究过程)________
结论:________
查看答案和解析>>
科目: 来源:枣庄市二OO七届高三第一次调研考试、化学试题 题型:058
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:英德中学2007届高三化学第一轮复习单元测试第二单元、物质结构与性质 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:新星高级中学2006-2007学年高三统一考试、化学专业试卷(一)(人教) 人教 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:厦门双十中学2007届高三年级上学期半期考、化学试题 题型:058
(1)合成氨工业生产中所用的α—Fe催化剂的主要成分是FeO、Fe2O3.当催化剂中Fe2+与Fe3+的物质的量之比为1:2时,其催化剂活性最高.以Fe2O3为原料制备上述催化剂,可向其中加入适量炭粉,发生如下反应:
2Fe2O3+C=4FeO+CO2↑.为制得这种活性最高的催化剂,应向480gFe2O3粉末中加入炭粉的质量为________g.
(2)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,发生反应如下:
MnO4-+Cu2S+H+→Cu2++SO2++Mn2++H2O
MnO4-+CuS+H+→Cu2++SO2++Mn2++H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应(KMnO4的还原产物为Mn2+).
则Cu2S和CuS的混合物中Cu2S的质量分数为________.
(3)已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
N2O(1)=H2O(g);△H=+44kJ/mol
发射卫星用肼(即N2H4)的气体为原料,以NO2气体为氧化剂,两种物质反应生成氮气和液态水,试写出该反应的热化学方程式:________.
(4)用24.5%硫酸溶液(密度为1.20g/cm3)配制100ml0.20mol/L硫酸溶液时,要用到的玻璃仪器有:容量瓶、酸式滴定管、烧杯、胶头滴管和________.使用容量瓶时应先检查其是否________;用刚洗净的酸式滴定管量取24.5%硫酸溶液时,应先________,然后量取________mL24.5%硫酸溶液进行配制.
(5)现有足量铝屑、含1molH2SO4的浓硫酸、含1.5molNaOH的氢氧化钠溶液和水.①若用上述原料制取氢气,有以下两个方案:
方案一:用铝屑和氢氧化钠溶液制取氢气
方案二:用铝屑、浓硫酸和水制取氢气
你认为最好的方案是________其理由是:________.
②制取氢氧化铝可以有几种不同的方法.若用上述原料最多能制得________gAl(OH)3
查看答案和解析>>
科目: 来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:通州市2006—2007学年(上)高三期中调研测试、化学试卷 题型:058
Ⅰ.探究有关物质氧化性的强弱.
Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色.取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下.
①滴加适量的NaBiO3溶液,溶液变为紫红色.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生.
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色.
④最后通入足量的SO2气体.
请回答下列问题:
(1)推测实验④中的现象为________.
(2)分析上述现象,KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________.
Ⅱ.探究镁、铝、铁金属单质还原性的强弱.
现有镁条、铝片、铝粉、铁钉、氧化镁、氧化铝、氧化铁、盐酸、稀硫酸、硝酸及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证镁、铝、铁金属单质的还原性强弱.
依据你设计的实验方案,回答下列问题:
(3)实验原理:用化学方程式表示实验中的反应①________、②________、③________
(4)实验现象:能够充分说明镁、铝、铁金属单质还原性强弱的明显现象是________.
(5)实验结论:你得到的实验结论是________.
查看答案和解析>>
科目: 来源:四川省蓬安中学2007级高三第一次月考化学试题 题型:058
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.
[方案I](1)称取碳酸钙样品Mg;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积VmL.
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会________(偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品Mg;
(2)用cmol/L盐酸VmL(过量)溶解样品;
(3)取溶解后的溶液![]() mL,用C′mol/LNaOH溶液滴定,恰好用去V′mL.
mL,用C′mol/LNaOH溶液滴定,恰好用去V′mL.
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)________.
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定________(填选项编号).
A、需要
B、不需要
C、均可
问题3:碳酸钙纯度计算公式________.
[方案III](1)称取碳酸钙样品Mg;(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g.
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?________;
问题2:本方案中的“冷却”应如何操作________.
[方案IV](1)称取碳酸钙样品Mg;
(2)加入足量Cmol/L盐酸VmL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/LNa2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g.
问题1:此方案中不需要的数据是________(填选项编号).
A、C、V、B、C′、V′、C、M′、D、M
问题2:为减少实验误差,必要的操作是________(填选项编号).
A、精确测定Na2CO3溶液体积V′mL
B、精确配制浓度C′mol/LNa2CO3溶液
C、将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D、将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度将________(偏高、偏低、无影响).
综上所述,你认为4个方案中,最好的方案是________,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案________;________.
方案________;________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com