相关习题
0 95717 95725 95731 95735 95741 95743 95747 95753 95755 95761 95767 95771 95773 95777 95783 95785 95791 95795 95797 95801 95803 95807 95809 95811 95812 95813 95815 95816 95817 95819 95821 95825 95827 95831 95833 95837 95843 95845 95851 95855 95857 95861 95867 95873 95875 95881 95885 95887 95893 95897 95903 95911 203614
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
根据下面给出的药品和实验装置,设计一个实验,粗略测定由铜和锌两种金属组成的合金-黄铜中锌的质量分数(黄铜已加工成粉末).
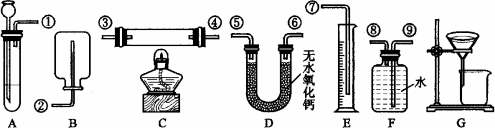
药品:稀硫酸、浓硫酸、氧化铜
实验装置:
另有托盘天平可用,根据你设计的实验方案回答下列问题:
| (1) |
|
(2) |
|
你选用的实验装置有(填装置编号)________.若需要组装,则连接的顺序是(用装置接口出的编号表示)________(若不需要组装,则不填).
|
|
(3) |
|
称取a g黄铜粉样品进行实验,实验中你测定的其他有效数据是
A.生成H2的体积b L
B.反应前仪器和药品的质量c g
C.反应后剩余固体的质量d g
D.反应后仪器和药品的质量e g
|
|
(4) |
|
|
查看答案和解析>>
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01 mol/L、0.008 mol/L等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理
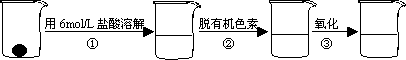
③准确量取一定体积的待测液于溶液中(比色管),加入稍过量的KSCN溶液,并稀释到10 mL.
④比色,直到与选取的标准颜色一致或相近即可.
试回答下列问题:
| (1) |
|
配制100 mL 0.01 mol/L溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:________、________.
|
|
(2) |
|
步骤②脱色过程包括加入:________(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→________(填操作).
|
|
(3) |
|
(4) |
|
若其补铁剂是由乳酸(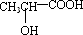 )与铁粉作用生成的,请写出该反应的化学方程式:________ )与铁粉作用生成的,请写出该反应的化学方程式:________
|
|
|
查看答案和解析>>
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I- I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63- I3-,又知氧化性:Fe3+>Cu2+>I2>FeF63-
析出I2可用c mol/L Na2S2O3标准溶液滴定:2S2O32-+I3- S4O62-+3I-. S4O62-+3I-.
准确称取a g胆矾试样,置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol/L H2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀.盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入1~2 mL 0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去V mL标准液.
| (1) |
|
实验中,在加KI前需加入少量NaF,推测其作用可能是________
|
|
(2) |
|
(3) |
|
本实验中用碘量瓶而不用普通锥形瓶是因为:________
|
|
(4) |
|
硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:________
|
|
(5) |
|
根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)=________
|
|
|
查看答案和解析>>
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验.
| (1) |
|
甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量.确定CaCl2溶液是否过量的方法是________,洗涤沉淀并判断沉淀是否洗净的操作是________.
|
|
(2) |
|
乙组:气体分析法
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是________,选用该溶液后实验结果还是不准确,原因是________.
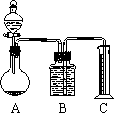
|
|
(3) |
|
请你设计一个与甲、乙两组操作不同的实验方案,测定混合物中Na2CO3的含量.
方法:________.
用到的主要试剂:________(至少2种).
用到的玻璃仪器:________(至少2件).
|
|
|
查看答案和解析>>
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00 mol/L的HCl溶液和1.00 mol/L的NaOH溶液;
②每次取1.00 g此化肥样品,溶于20 mL蒸馏水中;
③加入30.00 mL 1.00 mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④________;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
| (1) |
|
写出步骤④中的实验内容________,写出实验步骤④中的离子方程式:________.
|
|
(2) |
|
下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
|
A. |
玻璃棒
|
B. |
托盘天平
|
C. |
烧杯
|
D. |
漏斗
|
|
(3) |
|
(4) |
|
配制本实验所需的1.00 mol/L的盐酸和1.00 mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为
|
| [ ] |
A. |
50 mL,50 mL
|
B. |
150 mL,100 mL
|
C. |
100 mL,150 mL
|
D. |
250 mL,500 mL
|
|
(5) |
|
若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为________.(不需要化简)
|
|
|
查看答案和解析>>
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
某学生取纯净的Na2SO3·7H2O 50.00 g,在密闭容器中经600℃以上的强热至恒重,分析及计算表明,恒重后的样品质量相当于无水亚硫酸钠的计算值,而且各元素的组成也符合计算值,但将它溶于水,却发现溶液的碱性大大高于同时配制的亚酸钠溶液.经过他的实验和思考,这位同学解释了这种反常现象.
| (1) |
|
他将恒重后的样品溶于水配成溶液,为加速溶解,可采取________的措施,观察发现样品全部溶解,溶液澄清.
|
|
(2) |
|
取少量(1)中所配溶液,加入足量的用________(填一种酸)酸化的氯化钡溶液有白色沉淀,说明产物中含有________(填离子符号).
|
|
(3) |
|
另取少量(1)中所配溶液于试管中,滴加少量盐酸,看到气泡产生,通过________方法闻到臭鸡蛋气味,说明生成________气体,写出生成该气体的离子反应方程式:________;同时发现溶液变浑浊,原因是:(用离子方程式表示)________.
|
|
(4) |
|
根据以上实验,该同学经分析解释了以上实验中的反常现象,请你用一个化学方程式表示:________.这一反应在上述实验中________(填“是”或“否”)能确定反应完全.
|
|
|
查看答案和解析>>
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
某种含有少量氧化钠的过氧化钠试样(试样质量为1.560 g、锥形瓶和水的质量190.720 g),利用如图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
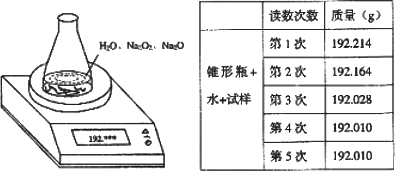
| (1) |
|
写出Na2O2和H2O反应的化学方程式________
|
|
(2) |
|
计算过氧化钠质量分数时,必需的数据是________不必作第6次读数的原因是________
|
|
(3) |
|
测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:

①操作Ⅱ的名称是________
②需直接测定的物理量是________
③测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要________、________(固定、夹持仪器除外)
④在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果________(填偏大、偏小或不变).
|
|
|
查看答案和解析>>
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
已知某纯碱试样中含有NaCl杂质,为测定试样中的纯碱的质量分数,可用如图中的装置进行实验.
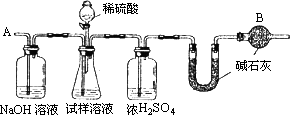
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6 mol·L-1的硫酸,直到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
| (1) |
|
在用托盘天平称量样品时,如果天平的指针向左偏转,说明________;
|
|
(2) |
|
(3) |
|
如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果________(填偏高、偏低或不变)
|
|
(4) |
|
(5) |
|
(6) |
|
该试样中纯碱的质量分数的计算式为________;
|
|
(7) |
|
还可以用其他实验方法测定试样中纯碱的质量分数.请简述一种不同的实验方法.
简述实验步骤.
|
|
|
查看答案和解析>>
科目:
来源:广东北江中学2007高三第二轮定量实验专题练习、化学
题型:058
|
|
一般测定样品成分含量的实验应重复二至三次.为了测定某氢氧化钠固体中混有的碳酸钠的质量分数,甲、乙两位同学分别设计了如下实验方案:
| (1) |
|
甲同学的方案如图所示:
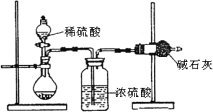
(1)根据甲同学的实验装置图分析,在每次实验过程中所进行的称量操作至少要进行4次.
(2)甲同学重复测定了三次,得到碳酸钠的质量分数的数据存在较大的偏差,你认为原因可能是
|
A. |
装置内原有空气中的二氧化碳气体也被碱石灰吸收
|
B. |
装置外空气中的水蒸气和二氧化碳被碱石灰吸收
|
C. |
反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
|
D. |
加入稀硫酸的量不足,则可能造成误差
|
|
(2) |
|
乙同学的方案是:称取样品m g,并溶解,加过量氯化钡溶液,过滤、洗涤、烘干,称量得固体n g
(1)混合物中碳酸钠的质量分数为(用m、n表示)________.
(2)洗涤沉淀的操作要点是________.
(3)Ca2+、Ba2+都可以使CO32-沉淀完全,但乙同学使用氯化钡溶液而不用氯化钙溶液的原因是________;测定CO32-的量,若使用氢氧化钡溶液而不用氢氧化钙溶液,结果将具有更高的精确度,原因是________.
|
|
|
查看答案和解析>>
科目:
来源:长乐二中2007年高考化学实验预测题
题型:058
|
|
摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂.某研究性学习小组设计了下面的实验装置来制备摩尔盐.
实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中.
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4.
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐.

试回答下列问题:
| (1) |
|
(2) |
|
Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞________,并同时打开活塞________.
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用________
|
|
(3) |
|
使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶.你认为较好的方法是________.(填序号)
|
|
(4) |
|
原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵.请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):________、________.
|
|
|
查看答案和解析>>
