
科目: 来源:新课标2007年高考化学模拟试题(山东卷) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:新课标2007年高考化学模拟试题(山东卷) 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:新课标2007年高考化学模拟试题(山东卷) 题型:058
在课堂上,老师演示了金属Na与CuSO4溶液反应的实验,同学们观察到该反应中生成了蓝色的Cu(OH)2沉淀而没有发现Cu单质生成.但某同学心中在想,会不会是因为生成的Cu较少而被蓝色沉淀所覆盖从而没有被发现呢?于是想课后到实验室继续研究,希望进一步用实验来验证自己的猜想是否正确.
假如该同学是你,请你写一份实验准备单交给老师,要求老师提供必需的用品.
(1)实验探究的目的:________.
(2)探究所依据的化学原理:________.
(3)实验必需的用品:小刀、玻璃片、滤纸、________和________;金属Na、________和________.
该同学在探究实验中意外地发现生成的蓝色的沉淀中混有少量的黑色沉淀,而所使用的药品均没有问题.你认为该黑色难溶物是________,生成该黑色难溶物的原因是________.
查看答案和解析>>
科目: 来源:新课标2007年高考化学模拟试题(山东卷) 题型:058
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:新课标2007年高考化学模拟试题(山东卷) 题型:058
(1)某化学小组的同学在学习了NaHCO3和Na2CO3的有关知识后,进行如下实验:在两支试管中分别加入3 mL、4 mol·L-1稀盐酸,将两个各装有0.3 g NaHCO3或Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:

①试管中(填产生沉淀或气体及反应速率等相关现象)________.
②盛________的试管中气球变得更大,大小气球(包含试管)体积之比约为(填最简单整数比)________;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.类似如中和热,甲同学写出了下列热化学方程式:
HCO3-(aq)+H+(aq)=H2O(l)+CO2(g);△H>0
CO32-(aq)+2H+(aq)=H2O(l)+CO2(g);△H<0
甲下结论的方法是否正确________(填“正确”或“不正确”)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
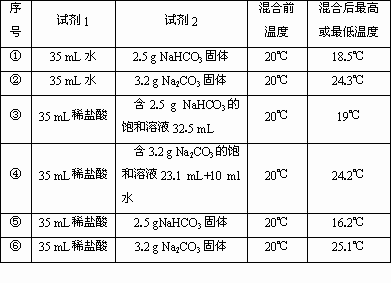
请你帮助填写相关内容:
①该研究报告的题目是《________》;
②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为________和________;通过上述实验可得出五条结论:
a:NaHCO3的溶解是________(“吸热”或“放热”)过程;
b:Na2CO3的溶解是________(“吸热”或“放热”)过程;
c:NaHCO3的饱和溶液和盐酸的反应是________(“吸热”或“放热”)反应;
d:Na2CO3的饱和溶液和盐酸的反应是________(“吸热”或“放热”)反应;
e:NaHCO3固体与稀盐酸反应的反应热是________(填a→d的字母)的热效应之和.
查看答案和解析>>
科目: 来源:如东县2007年高考化学模拟试题(一) 题型:058
I、下表是如东某超市出售的“淮牌”加碘精制盐的有关说明:

II、下面是某网站上刊出的有关碘及碘的化合物的有关信息:
自然界中碘主要以碘化物和碘酸盐的形式存在.碘在海水中的含量甚微(5×10-8%),但海洋中某些生物如海带、海藻等具有选择性吸收和聚积碘的能力,因而干海藻是碘的一个重要来源.目前世界上碘主要来自智利硝石,其中含碘0.02%~1%,智利硝石中碘主要以碘酸钠(NaIO3)的形式存在.通常情况下碘是一种紫黑色固体,易升华,只能少量溶于水得棕黄色的碘水溶液,但易溶于苯、四氯化碳等有机溶剂,紫色的碘蒸气有刺激性气味,能强烈刺激眼、耳、鼻、气管等粘膜,吸入较多的碘蒸气会发生中毒,甚至造成死亡.碘遇淀粉(面粉的主要成分)会出现明显的蓝色.碘离子(I-)具有明显的还原性,而高价态的碘则具有较强的氧化性:
2NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2…………⑴
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2…………⑵
反应⑴是自海藻灰中提取碘的主要反应,反应⑵是自智利硝石中提取碘的主要反应.
根据以上信息,回答下列问题:
⑴反应⑴、反应⑵的离子方程式是(亚硫酸氢钠的电离方程式是:NaHSO3=H++HSO3-)反应⑴:________;反应⑵:________;I2在反应⑴中是________(填“氧化”或“还原”,下同)产物,在反应⑵中是________产物;
⑵请你设计实验探究上述“淮牌”精制盐中是否真的含有碘元素.
实验名称:探究“淮牌”精制盐中是否含有碘元素
实验目的:1.认识碘酸钾中的碘元素转变成碘单质的化学反应;
2.________.
实验原理:(提示:结合题中信息和实验目的进行分析)________.
实验用品:(提示:实验用品通常包括仪器和药品,根据你设计的实验填写)________.
实验步骤:(用准确、简洁的语言填写下表)

问题讨论:如东有100多km的海岸线,海产品丰富,海产品中或多或少的含有碘元素,而海产品又是如东人的主要副食品,如东人的食用盐中需要加碘吗?说明你的理由.
查看答案和解析>>
科目: 来源:如东县2007年高考化学模拟试题(一) 题型:058
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:如东县2007年高考化学模拟试题(一) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:启东市汇龙中学迎二模模拟考试(二)、化学 题型:058
| |||||||||||
查看答案和解析>>
科目: 来源:启东市汇龙中学迎二模模拟考试(二)、化学 题型:058
| |||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com