
科目: 来源:深圳外国语学校2008届高三年级第二次质量检测化学试题 题型:058
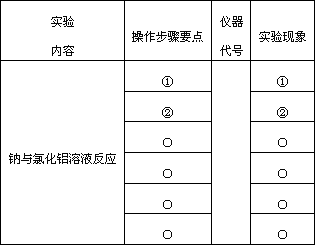
实验室里有如下仪器和药品,请设计如下实验的操作步骤要点“○”可不填满),并指出可能发生的实验现象.
仪器或用品:①试管 ②烧杯 ③玻璃片 ④石棉网 ⑤滤纸 ⑥火柴 ⑦镊子 ⑧酒精灯 ⑨药匙 ⑩集气瓶
药品:①金属钠(在煤油中) ②AlCl3溶液 ③蒸馏水 ④细沙
查看答案和解析>>
科目: 来源:山西省实验中学2008届高三年级第一次月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:南昌二中2008届高三第一次考试化学试卷 题型:058
近年来全世界经历了多种传染性疾病(如非典、疯牛病、高致病性禽流感等)的袭扰,因此,经常性地对环境进行消毒,是预防各种传染性疾病的有效措施.某研究小组为制备消毒液(主要成分是NaClO),设计了A、B两套装置(B装置中电极材料均为石墨).并查阅到下列资料:在加热的情况下卤素单质和碱液发生如下反应:
3X2+6OH-![]() 5X-+
5X-+![]() +3H2O
+3H2O
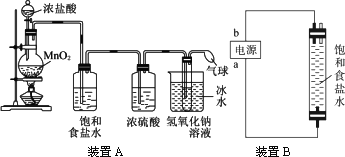
请完成下列问题:
(1)写出装置A烧瓶中发生反应的化学方程________.
(2)若去掉装置A中盛浓硫酸的洗气瓶,能否达到预期目的________(填“能”或“不能”).
(3)装置A中盛冰水的烧杯的作用是________________.
(4)利用装置B制备消毒液时有关反应的化学方程式为________.
(5)装置B中a端应接电源的________极,理由是_________________________.
查看答案和解析>>
科目: 来源:江西吉安一中2007-2008学年度上学期高三第一次段考化学试卷 题型:058
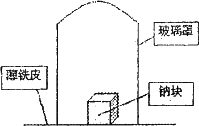
据材料称:钠可在氮气中燃烧生成氮化钠,氮化钠与水反应的化学方程式是:Na3N+4H2O=3NaOH+NH3·H2O.某学校化学研究学习小组,为了研究钠在空气中燃烧产物的成分,做了发以下实验:
取11.5 g钠单质放在一块薄铁皮上,上扣一玻璃罩(玻璃罩内为干燥且无酸性气体的空气),用酒精灯加热薄铁皮,钠完全燃烧,将燃烧产物投入水中,得到一种纯净气体0.224L(标准状态)和1.00L溶液,从中取出25.0 mL溶液,和13.5 mL 1.00 mol·L-1HC1溶液刚好完全反应.求钠在空气中燃烧产物的成分及物质的量.
查看答案和解析>>
科目: 来源:江苏省扬中高级中学2007-2008届高三化学第二次月考化学试卷 题型:058
某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁.现用滴定法测定该样品中FeC2O4的含量.滴定反应是:
5Fe2++5C2O42-+3MnO4-+24H+![]() 5Fe3++10CO2↑+3Mn2++12H2O
5Fe3++10CO2↑+3Mn2++12H2O
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高H锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b mL
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5-8 min,经检验溶液合格后,继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c mL
③_____________________________________.
④数据处理.
请回答下列问题:
(1)上述实验方案中的步骤③是____________________________________.
(2)洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、检验活塞是否漏水.
Ⅱ________________________________________________________________
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡,调节起始读数.
(3)步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有__________溶液的试管中,如_____________,则说明溶液合格.
(4)某小组的一次测定数据记录如下:
根据数据计算0.1970 g样品中:n(Fe2+)![]() _________;n(C2O42-)
_________;n(C2O42-)![]() _________;FeC2O4的质量分数为______________(精确到0.01%)
_________;FeC2O4的质量分数为______________(精确到0.01%)
查看答案和解析>>
科目: 来源:江苏省泰州第二中学2007——2008学年度第一学期高三摸底化学考试 题型:058
海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:


请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是______________(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是______________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_____________________________________________.
(3)步骤④反应的离子方程式是___________________________________________________.
(4)步骤⑤中,某学生选择用苯来提取碘的理由是___________________________________.
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:_______________.
查看答案和解析>>
科目: 来源:江苏省泰州第二中学2007——2008学年度第一学期高三摸底化学考试 题型:058
根据实验室中测定硫酸铜晶体结晶水含量的实验,填写下列空白:
(1)从下列仪器中选出所需仪器(用标号字母填写)__________.
A.托盘天平(带砝码) B.研钵 C.试管夹 D.酒精灯 E.蒸发皿
F.玻璃棒 G.坩埚 H.干燥器 I.石棉网 J.三脚架
除上述仪器外,还需要的仪器是_________________.
(2)某学生实验后得到以下数据:
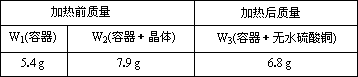
请写出结晶水含量(x%)的计算公式(用W1、W2、W3表示)x%=_____________.
该生测定结果是偏高还是偏低?________________.
从下列分析中选出该学生产生实验误差的原因可能是(填写字母)_______.
A.加热前称量时容器未完全干燥 B.最后两次加热后的质量相差较大(大于0.1 g)
C.加热后容器未放入干燥器中冷却 D.加热过程中晶体有少量溅失
查看答案和解析>>
科目: 来源:江苏省宿豫中学2008届高三学期初调研考试化学试 题型:058
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上.
实验所用仪器:a蒸发皿 b石棉网 c泥三角 d表面皿 e坩埚钳 f试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是________
a灼烧过程中部分氧化铜被还原 b灼烧不充分铜未被完全氧化
c氧化铜在加热过程中分解生成铜 d该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:________、________
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行________次
(6)若测定结果x值偏高,可能的原因是________
a加热温度过高 b胆矾晶体的颗粒较大
c加热后放在空气中冷却 d胆矾晶体部分风化
查看答案和解析>>
科目: 来源:江苏省南海中学2008届高三化学第一次月考试题 题型:058
研究性学习小组进行SO2的制备及性质探究实验.
(1)根据反应Na2SO3(固)+H2SO4(浓)![]() Na2SO4+SO2↑+H2O,制备SO2气体.
Na2SO4+SO2↑+H2O,制备SO2气体.
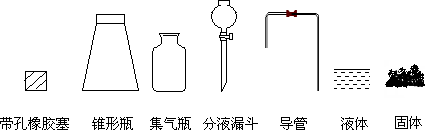
①用下列简图,在下面画出制备并收集SO2的实验装置(含试剂)示意图.
②实验过程中,使用分液漏斗滴加浓硫酸的操作是________________.
(2)将SO2气体分别通入下列溶液中:
①溴水溶液,现象是________________________________________.
②硫化钠溶液,现象是_____________________________________.
查看答案和解析>>
科目: 来源:江苏省高淳高级中学2008届高三质量检测化学试卷 题型:058
氯化钙是用途广泛的化学试剂,可作干燥剂、冷冻剂、防冻剂等.为了测定某氯化钙样品中钙的含量,进行如下实验:
①准确称取氯化钙样品0.2312 g,放入烧杯中,加入适量6 mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35 mL 0.25 mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀,经检验,Ca2+已沉淀完全.
②过滤并洗涤①所得沉淀.
③加入足量的10%H2SO4和适量的蒸馏水,②中沉淀完全溶解,溶液呈酸性,加热至75℃,趁热加入0.05 mol/L KMnO4溶液16 mL,恰好完全反应.
回答下列问题:
(1)配平:________MnO4-+________H2C2O4+________H+―________Mn2++________CO2↑+________H2O
(2)0.05 mol·L-1 KMnO4标准溶液应置于________(选填“酸式”或“碱式”)滴定管中;判断滴定终点的现象为________________.
(3)计算该氯化钙样品中钙元素的质量分数(精确到0.01%).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com