
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-硫及其化合物 题型:058
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的部分工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O.
②160 g/LNaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1 L.
(1)吸收塔内的反应的化学方程式为
2NaOH+2ClO2+H2O2![]() 2NaClO2+2________+________,
2NaClO2+2________+________,
若1 mol ClO2参加反应,则转移电子的物质的量是________mol;
(2)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________(选填序号),
a.蒸馏
b.蒸发
c.灼烧
d.过滤
e.冷却结晶
要得到更纯的NaClO2·3H2O晶体必须进行的操作是________(填操作名称);
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是________;
(4)160 g/L NaOH溶液的物质的量浓度为________,若要计算该溶液的质量分数,还需要的一个条件是________(用文字说明).
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-硫及其化合物 题型:058
在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀.然后加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体.请回答:
(1)生成的黑色(单质)物质是________(填化学式).
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是________(填化学式),这种黑色物质继续与浓硫酸作用,产生两种气体的化学方程式为________
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有________(填序号).
A.酸性
B.吸水性
C.脱水性
D.强氧化性
(4)将实验②产生的刺激性气味气体通入品红溶液,可以看到品红溶液________说明这种气体具有________性;将②中产生的刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式________
(5)能否用澄清石灰水鉴别这两种气体?________(填“能”或“不能”)若不能请填写两种能鉴别的试剂________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-硫及其化合物 题型:058
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4后层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀.
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由.
实验①________;
实验②________;
实验③________;
实验④________;
实验⑤________;
(2)上述5个实验不能确定是否存在的离子是________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-离子反应 题型:058
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复).现做如下实验:
①A和E的溶液显碱性,0.1 mol/LA溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀.
(1)根据以上事实推断A~E的化学式:
A________、B________、C________、D________、E________
(2)写出②、③、④的离子方程式:
②_________________
③_________________
④_________________
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-碱金属 题型:058
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O![]() NH4Cl+NaHCO3↓依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
NH4Cl+NaHCO3↓依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
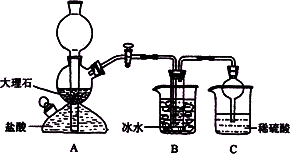
(1)A装置中所发生反应的离子方程式为:________.
C装置中稀硫酸的作用为:____________________.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水)

参照表中数据,请分析B装置中使用冰水是因为________.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在________装置之间(填写字母)连接一个盛有________的洗气装置,其作用是________.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-电化学(2) 题型:058
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
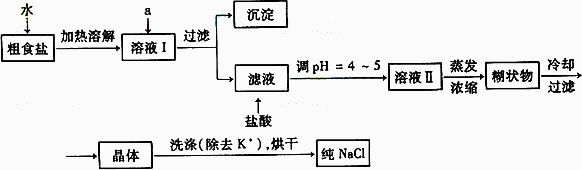
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________(填选项)
A.蒸馏水
B.75%的乙醇溶液
C.无水乙醇
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除药匙、玻璃棒外还有________(填仪器名称).
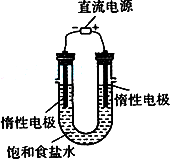
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为________.
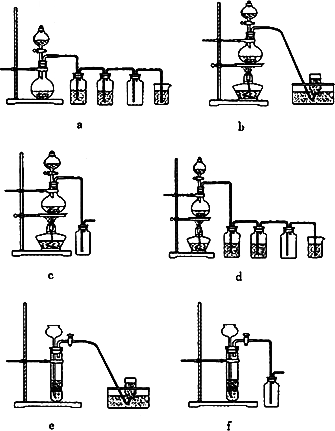
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4![]() ZnSO4+H2↑
ZnSO4+H2↑
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).
可选用制备气体的装置:
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-电化学(1) 题型:058
已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应).某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.
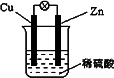
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的________极相连.阴极上的电极反应式为________电解过程中,硫酸铜的浓度会________(选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:________
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
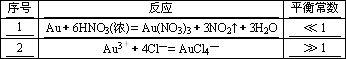
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:__________
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
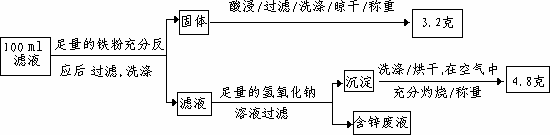
则100 mL滤液中Cu2+的浓度为________mol·L-1,Fe2+的浓度为________mol·L-1
查看答案和解析>>
科目: 来源:安徽省蚌埠二中2009届高三12月月考化学试题人教版 题型:058
某固体混合物可能由KNO3、K2SO4、KI、NaCl、CuCl2、CaCl2和Na2CO3中的一种或几种组成.依次进行下列五步实验,观察到的现象记录如下:
①混合物加水得无色透明溶液
②向上述溶液中滴加BaCl2溶液有白色沉淀生成,将该沉淀滤出,并将滤液分成两份;
③上述白色沉淀可完全溶于稀盐酸;
④往一份滤液中滴加氯水并加入CCl4,振荡后静置,CCl4层无色;
⑤往另一份滤液中加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀硝酸.
根据以上实验,可以判断出混合物中肯定含有________;但不能判断出是否含有________;为确证混合物的组成,还须做________实验.
查看答案和解析>>
科目: 来源:2009年湖南省师大附中高三第一次月考化学试卷人教版 人教版 题型:058
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:

(1)电源A的a为________极;
(2)滤纸B上发生的总化学方程式为:________;
(3)欲在电镀槽中实现铁上镀锌,接通K点,则电极e上发生的反应为:________,槽中盛放的电镀液可以是________.
查看答案和解析>>
科目: 来源:上海市凤城高中2009届高三寒假模拟考试、化学试题 题型:058
50 mL 0.5 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在下图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.

请回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________;由图可知该装置有不妥之处,应如何改正?________________.
(2)烧杯间填满碎塑料泡沫的作用是________.
(3)大烧杯上如不盖硬纸板,则求得的中和热数值________(填“偏大”、“偏小"、“无影响”).
(4)实验中改用60 mL 0.50 mol/L的盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”),理由是________;若实验操作均正确,所求中和热的数值会________(填“相等”或“不相等”),
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com