
科目: 来源:湖南师大附中2009届高三第五次月考化学试题 湘教版 湘教版 题型:058
现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”,“纸漏斗的下部被烧穿,有熔融物落入沙中”.
(1)某同学推测,Al与Fe2O3发生的铝热反应所得的熔融物是铁铝合金.设计一个简单的实验方案,证明上述所得的熔融物中含有金属铝.填写下表:

(2)实验室欲熔解此熔融物,最好使用下列试剂中的________(填序号),不用其他试剂的理由是_______________.
A.浓硫酸
B.稀硫酸
C.稀硝酸
D.NaOH溶液
查看答案和解析>>
科目: 来源:湖南师大附中2009届高三第五次月考化学试题 湘教版 湘教版 题型:058
A、B均为一种正盐,将A溶液和B溶液混合后得到的澄清溶液中,所含的离子是Cl-、CO![]() 、SO
、SO![]() 、NH
、NH![]() 、K+、Mg2+、Al3+七种离子中的某几种.
、K+、Mg2+、Al3+七种离子中的某几种.
实验:①原溶液逐滴加入NaOH先产生白色沉淀,最终白色沉淀完全消失
②将①所得溶液![]() 放出使紫色石蕊试液变蓝的气体
放出使紫色石蕊试液变蓝的气体
③原溶液中加BaCl2溶液不产生沉淀
回答下列问题:
(1)A或B是________或________.
(2)在A和B组成的混合溶液中,滴加0.2 mol/L NaOH溶液.下列反映该变化过程的图象是________;A和B的物质的量分别为________和________.

查看答案和解析>>
科目: 来源:湖南省长沙市一中2009届高三第五次月考化学试题 题型:058
已知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4.三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某化学兴趣小组通过实验来探究某红色粉末是Fe2O3或Cu2O或两者的混合物.(实验所需试剂只能从下列中选择:稀硫酸、KSCN溶液、稀硝酸、双氧水、铁粉、碱式碳酸铜)
(1)探究方案:将红色粉末溶于足量的稀硫酸中;实验现象:反应后有红色固体存在;
结论:红色粉末是Cu2O或Fe2O3和Cu2O的混合物.
(2)如果红色粉末是Fe2O3和Cu2O的混合物,请设计实验证明之.
实验方法:取少许红色粉末溶于足量稀硫酸中,充分溶解后滴加KSCN溶液,再滴加双氧水;
实验现象:有红色固体生成,加KSCN溶液不显红色,再加双氧水后显红色.
(3)兴趣小组欲利用Fe2O3和Cu2O的混合物制取较纯净的胆矾(CuSO4·5H2O).经查阅资料得知:在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
实验小组设计如下实验方案:
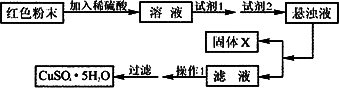
试回答:
①试剂1为________;试剂2为_______(填名称);
②固体C的化学式为________;
③操作1为________.
查看答案和解析>>
科目: 来源:湖南省长沙市一中2009届高三第五次月考化学试题 题型:058
氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.1000 mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)配平离子方程式:________
(2)滴定过程中,NaHSO3溶液的体积是20.00 mL,消耗0.100 mol/L的酸性KMnO4溶液16.00 mL,则NaHSO3溶液的物质的量浓度是________.
(3)下列操作会导致测定结果偏高的是________
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目: 来源:湖北省武汉市武昌区2009届高三元月调研考试化学试题 题型:058
某课外活动小组用下图装置对铜粉(含少量炭)样品进行实验.图中铁架台等装置已略去.请完成下列实验报告.
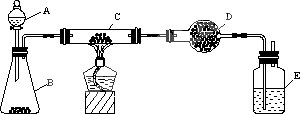
(一)实验目的:测定铜粉样品中铜的质量分数.
(二)实验用品:
仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等;
药品:红褐色铜粉(含少量炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等.
(三)实验内容:

(四)计算:
样品中铜的质量分数=________(用含W、m1、m2的代数式表示).
(五)问题和讨论:
实验完成后,老师评议说:按上述实验设计,即使C、D中反应完全,也不会得出正确的结论.经讨论,有的同学提出在B与C之间加入一个装置,该装置可以是________.再次实验后,得到了比较正确的结果.
查看答案和解析>>
科目: 来源:黑龙江哈尔滨九中2009届高三上学期第五次月考化学试题 题型:058
Ⅰ.根据下图及描述,回答下列问题:
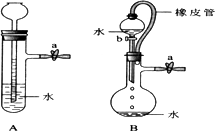
1).关闭图A装置中的止水夹a后,从长颈漏斗向试管中注入一定量的水,静置后如图所示.试判断:A装置是否漏气?(填“漏气”、“不漏气”、或“无法确定”)________,判断理由:________________.
2).关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶.试判断:B装置是否漏气?(填”漏气”、”不漏气”、或无法确定)________,判断理由:________.
Ⅱ.丙烯醛(CH2=CHCHO)中官能团的检验方法:________________.
写出含氧官能团检验对应的化学方程式:________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-有机化学基础(2) 题型:058
某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去.实验时,先加热玻璃管中的铜丝,约l min后鼓入空气.请填写下列空白:

(1)检验乙醛的试剂是________;
A、银氨溶液
B、碳酸氢钠溶液
C、新制氢氧化铜
D、氧化铜
(2)乙醇发生催化氧化的化学反应方程式为________;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是________,由于装置设计上的缺陷,实验进行时可能会________;
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行.进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示.

试解释鼓气速度过快,反应体系温度反而下降的原因:__________,该实验中“鼓气速度”这一变量你认为可用________来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色.该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应.请你设计一个简单的实验,探究哪一种猜想正确?________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-有机化学基础(2) 题型:058
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如下
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③________
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应≥________
(3)D装置的石棉中均匀混有KI粉末,其作用是________.
(4)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式________.
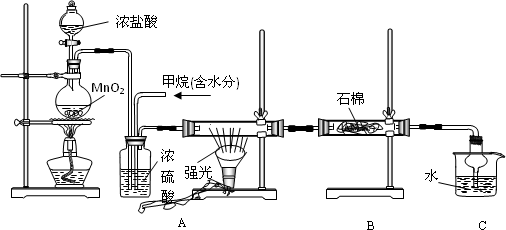
(5)E装置中除盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为________.
A.水洗分液法 B.蒸馏法 C.萃取分液法 D.结晶法
该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填编号)
A、CH4 B、CH3Cl C、CH2Cl2 D、CHCl3
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:058
某化学兴趣小组利用实验室提供的下列试剂:铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并对实验结果加于应用.
(1)根据氧化还原的有关原理,兴趣小组对Fe2+、Fe3+的氧化性、还原性提出了如下2种假设:
假设一:Fe2+既有还原性又有氧化性;
假设二:Fe3+具有氧化性;
(2)设计实验方案,进行实验并描述实验现象,完成下列表格.

(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了一个反应事实:FeCl2+Zn=ZnCl2+Fe,该反应的离子方程式为:________
(4)根据Fe3+的性质,该兴趣小组利用FeCl3溶液腐蚀铜箔制造印刷线路板,反应的离子方程式是:________
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-氧化还原反应 题型:058
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如下图所示:

请回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母).
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为________.
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的________(填字母);
A.NaOH B.Cu C.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生凝聚.将步骤Ⅱ中沉淀制成胶体后,再逐滴加入稀硫酸可能看到的现象是________.
(3)步骤Ⅲ应控制的实验条件是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com