
科目: 来源:天津市汉沽一中2009届高三上学期第三次月考化学试题人教版 人教版 题型:058
饱和氯水与石灰石的反应是制取较浓的HclO溶液方法之一.某同学运用这一方法,尝试制取HC1O溶液并进行了如下定性实验:
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验;
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生;
经检测,上述实验中产生的无色气体均为CO2气体.
(1)试解释可以在饱和氯水中加入石灰石制备HclO的原因___________.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______________.
第二份:______________.
(3)试根据所学知识推测,在②的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)___________.
查看答案和解析>>
科目: 来源:天津市汉沽一中2009届高三第四次月考化学试题 地区通用 题型:058
为确定某液态有机物X(分子式为C2H6O2)的结构,某同学准备按下列程序进行探究.请完成下列填空.己知:①一个碳上连两个究基的物质![]() 不稳定;②分子中不存在过氧键(-O-O-).
不稳定;②分子中不存在过氧键(-O-O-).
(1)根据价键理论预测X的可能结构为________、________、________(横线可不填满)
(2)设计实验方案证明X的结构(表格可不填满)

(3)根据实验方案,从下列仪器中选择所需仪器,画出实验装置图:
_________

要求:①本题装置示意图中的仪器可以用上面的方式表示
②铁架台、石棉网、酒精灯、连接胶管等,在示意图中不必画出.如需加热,在需加热的仪器下方,用“△”表示.
查看答案和解析>>
科目: 来源:四川省洪雅中学高三2009年二月份月考理综试题化学部分 题型:058
某校化学实验兴趣小组为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如图所示的实验装置,按要求回答问题:

(1)写出装置②中发生反应的化学方程式______________.
(2)请根据甲同学的意图,连接相应的装置应是(填接口字母代号):
b接________,________接________,________接a.
(3)U形接管中所盛放试剂的化学式为________.
装置③中CCl4的作用是________.
(4)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装装置⑤,你认为装置⑤应加在________之间(填装置序号)瓶中可以放入________.
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3的溶液换成其他溶液.你采取的措施是:________,则证明Cl2产生时有HCl挥发出来.
查看答案和解析>>
科目: 来源:山东省宁津高中2009学年高三第一次月考化学试题 题型:058
钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-.为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4后层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀.
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由.
实验①________________;
实验②________________;
实验③________________;
实验④________________;
实验⑤________________;
(2)上述5个实验不能确定是否存在的离子是________.
查看答案和解析>>
科目: 来源:山东省宁津高中2009学年高三第一次月考化学试题 题型:058
据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):

(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:________.
(2)某同学取X的溶液,酸化后加入KI.淀粉溶液,变为蓝色.写出与上述变化过程相关的离子方程式:________.
(3)写出Cl2将Z氧化为K2EO4的化学方程式:________.
(4)K2EO4作为水处理剂兼有Cl2和明矾的双重作用,请结合化学方程式进行说明:________
查看答案和解析>>
科目: 来源:江苏省金陵中学河西分校2009届高三化学月考试卷人教版 人教版 题型:058
某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引.为控究X的组成,他们进行了如下实验.
Ⅰ.定性检验

(1)实验②的目的是________.
(2)由上述实验现象推断,黑色粉末X的成分是________(填化学式).
Ⅱ.定量测定
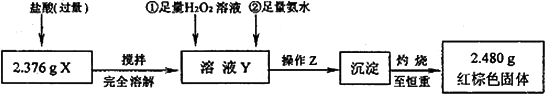
(1)操作Z是________.下列仪器中,在灼烧沉淀时必须用到的是________(填名称).

(2)写出溶液Y中滴加H2O2溶液是发生反应的离子方程式________.
(3)通过以上数据,得出2.376 g黑色粉末X中各成分的物质的量为________.
查看答案和解析>>
科目: 来源:江苏2009高三各地名校化学月考试题汇编(钠和碱金属) 题型:058
已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰.有两个实验小组的同学决定通过实验探究碱石灰的组成.
(1)第一小组设计方案的流程如下:

①写出n(OH-)、n(Ca2+)与n(Na+)的关系:n(Na+)=________.
②设n(Na+)=x mol、n(Ca2+)=y mol,请填写下表:

(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解.
他们设计了如下方案并得出相关数据:取市售碱石灰4.0 g,在250℃时加热至恒重,测得固体质量减少了0.42 g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75 g.请通过计算确定该碱石灰各成分的质量分数.
查看答案和解析>>
科目: 来源:江苏2009高三各地名校化学月考试题汇编(钠和碱金属) 题型:058
某中学化学教材上有如下介绍:“在氢氧化钠浓溶液中加入氧化钙,加热,制得白色固体就是碱石灰,它是水和二氧化碳的吸收剂”.有两个实验小组决定通过实验来探究碱石灰的组成.
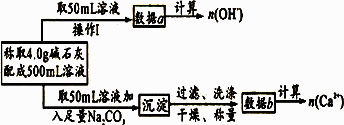
(1)第一小组设计的实验方案如下:
下列关于溶液中n(OH-)、n(Ca2+)、n(Na+)之间的关系式正确的是________
A.n(Na+)+2n(Ca2+)=n(OH-)
B.2n(Na+)+2n(Ca2+)=n(OH-)
C.n(Na+)+n(Ca2+)=2n(OH-)
现有4.0 g碱石灰,设其中n(Na+)=xmol,n(Ca2+)=ymol,请填写下列空格:
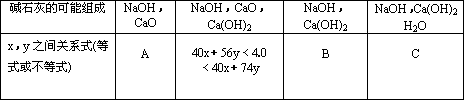
把表中A、C的关系式填在下面空格上:
A:________C:________.
(2)第二小组查得如下资料:氢氧化钙在250℃时不分解,高于250℃时才分解;氢氧化钠在580℃时不分解.他们设计了如下方案并得出相应相关数据:取市售碱石灰4.0 g,在250℃时加热至恒重,测得固体质量减少了0.6 g,剩余固体在580℃时继续加热至恒重,测得固体质量又减少了0.7 g.请通过计算确定该碱石灰各成分的质量分数?(要计算过程)
查看答案和解析>>
科目: 来源:湖南师大附中2009届高三第五次月考化学试题 湘教版 湘教版 题型:058
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式______________.
(2)若将(1)中的反应设计成原电池,请画出原电池装置图,标出正、负极.
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:_____________________.

(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀的现象明显.请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式__________________劣质不锈钢腐蚀的实验现象:_____________.
查看答案和解析>>
科目: 来源:湖南师大附中2009届高三第五次月考化学试题 湘教版 湘教版 题型:058
氮化铝(AIN)是一种新型的无机材料,广泛应用于集成电路生产领域.某氮化铝样品中含有碳或氧化铝杂质,现用图Ⅰ装置进行实验,使氮化铝样品与NaOH溶液反应(AlN+NaOH+H2O![]() NaAlO2+NH3↑),根据反应所生成氨的体积来测定样品中氮化铝的质量分数,并根据实验现象确定杂质的成分.实验过程记录如下:
NaAlO2+NH3↑),根据反应所生成氨的体积来测定样品中氮化铝的质量分数,并根据实验现象确定杂质的成分.实验过程记录如下:
a.检查装置气密性;b.往锥形瓶中放入适量氮化铝样品,从分液漏斗往锥形瓶中加入过量浓NaOH溶液,立即发生剧烈反应,生成的氨将广口瓶中的水排入量筒中;c.实验结束后,测量量筒中收集到的水的体积(包括由广口瓶到量筒的导管内的水柱的体积),进行计算.
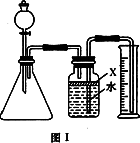
(1)本实验中,检查装置气密性的方法是________________.
(2)广口瓶中的试剂X宜选用________(填选项的标号).
A.丙烷
B.酒精
C.植物油
D.四氯化碳
(3)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是________.
(4)若实验中测得样品的质量为w g,氨的体积为a L(已折算成标准状况),则样品中AlN的质量分数为________.
(5)有人改用图Ⅱ装置进行同样实验,通过测定烧杯中稀硫酸的增重来确定样品中AlN的质量分数.你认为两种实验方案中,比较好的是用________装置进行实验(填“图Ⅰ”或“图Ⅱ”).理由是______________.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com