
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:058
请回答(1)和(2)两小题:
(1)下列说法正确的是________(选填序号)
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先要检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01 mol/L到0.008 mol/L等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液
②样品处理:

③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL.
④比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度.
试回答下列问题:
①配制100 mL 0.01 mol/L标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:________、________.
②步骤②脱色过程包括加入:________(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→________(填操作).
③步骤②样品处理中,氧化的目的是________.
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:058
某校学生利用以下装置验证氯气与氨气之间的反应(部分装置已略去).其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置.

请回答下列问题:
(1)装置A中发生反应的离子方程式为________.
(2)装置B中浓氨水与NaOH固体混合可制取氨气,其原因是________.
(3)装置C中氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种可参与生态循环的无毒气体,该反应的化学方程式为________,此反应可用于检查输送氯气的管道是否漏气.
(4)将装置C中反应生成的固体溶于水,所得溶液中离子浓度由大到小的顺序为________.
查看答案和解析>>
科目: 来源:天利38套《2008全国各省市高考模拟试题汇编(大纲版)》、化学 大纲版 题型:058
12.0 g某液态有机化合物A完全燃烧后,生成14.4 g H2O和26.4 g CO2.测得有机化合物A的蒸气与H2的相对密度是30,求:
(1)有机物A的分子式________.
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρ g/cm3)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1 mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为________(可以不化简).

查看答案和解析>>
科目: 来源:2009年高考化学(江苏卷) 题型:058
二氧化氧
(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl![]() 2ClO2↑+Cl2↑+2NaCl+2H2O
2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:
2NaClO3+H2O2+H2SO4用方法二制备的
ClO2更适合用于饮用水的消毒,其主要原因是________.(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子的含量应不超过0.2 mg·L-1.
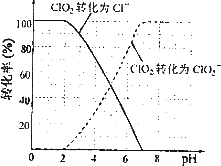
饮用水中CIO2、CIO2的含量可用连续碘量法进行测定.CIO2被I-还原为CIO-2、Cl-的转化率与溶液pH的关系如图所示.当pH≤2.0时,CIO-2也能被I-完全还原成Cl-.反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2![]() Na2S4O6+2NaI
Na2S4O6+2NaI
①请写出
pH≤2.0时,CIO-2与I-反应的离子议程式________.②请完成相应的实验步骤:
步骤
1:准确量取VmL水样加入到锥形瓶中.步骤
2:调节水样的pH为7.0~8.0.步骤
3:加入足量的KI晶体.步骤
4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL.步骤
5:________.③根据上述分析数据,测得该饮用水样中
CIO-2的浓度为________mol·L-1(用含字母的代数式表示.)④若饮用水中
ClO-2的含量超标,可向其中加入适量的Fe2+将ClO-2还原成Cl-,该反应的氧化产物是________(填化学式).查看答案和解析>>
科目: 来源:2009年高考化学(江苏卷) 题型:058
医用氯化钙可用于生产补钙、抗过敏和消炎等药物.以工业碳酸钙
(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+.检验Fe(OH)3是否沉淀完全的实验操作是________.
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③________.
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL.
①上述测定过程中需用溶液润洗的仪器有________.
②计算上述样品中CaCl2·2H2O的质量分数为________.
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有_________;________.
查看答案和解析>>
科目: 来源:2009年高考化学(海南卷) 题型:058
某含苯环的化合物
A,其相对分子质量为104,碳的质量分数为92.3%.(1)A的分子式为________:
(2)A与溴的四氯化碳溶液反应的化学方程式为________,反应类型是________;
(3)已知:![]() .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式________;
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式________;
(4)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式________;
(5)在一定条件下,由A聚合得到的高分子化合物的结构简式为________.
查看答案和解析>>
科目: 来源:2009年高考化学(海南卷) 题型:058
下图表示从固体混合物中分离
X的2种方案,请回答有关问题.
(1)选用方案Ⅰ时,X应该具有的性质是________,残留物应该具有的性质是________;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是________,有关反应的化学方程式为________;
查看答案和解析>>
科目: 来源:2009年高考化学(海南卷) 题型:058
Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAICl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2=4LiCl+S+SO2.
请回答下列问题:
(1)电池的负极材料为________,发生的电极反应为________;
(2)电池正极发生的电极反应为________;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成.如果把少量水滴到SOCl2中,实验现象是________,反应的化学方程式为________;
(4)组装该电池必须在无水、无氧的条件下进行,原因是________.
查看答案和解析>>
科目: 来源:2009年高考化学(海南卷) 题型:058
有关物质存在如图所示的转化关系
(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.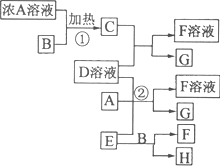
请回答下列问题:
(1)反应①的化学方程式为________
(2)反应②的离子方程式为________
(3)写出另外一种实验室制取H的化学方程式________
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9.将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1.0×10-2 mo1/L,则生成沉淀所需Pb(NO3)2溶液的最小浓度为________.
查看答案和解析>>
科目: 来源:2009年高考化学(广东A卷) 题型:058
超细氧化铝是一种重要的功能陶瓷原料.
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3该沉淀高温分解即得超AK6NH4AlO(OH)HCO3细热分解的化学反应方程式________.
(2)NH4Al(SO4)2·的相对分子质量为453.欲配制100 ml PH为2浓度约为0.1 mol________1的NH4Al(SO4)2溶液,配制过程为
①用托盘天平称量NH4Al(SO4)2·12H2O固体________g
②将上述固体置于烧杯中
________(3)在0.1 mol·l-1NH4 Al(SO4)2溶液中,铝各形态的浓度(以Al3+计)的对数(lgc)随溶液ph变化的关系见下图

①用
NaOH溶液调节(2)中溶液ph至7,该过程中发生反应的离子方程式有________②请在答题卡的框图中,画出0.01 mol·l-1NH4 Al(SO4)2溶液中铝各形态的浓度的对数lgc随溶液ph变化的关系图,并进行必要的标注.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com