
科目: 来源:浙江省杭州宏升高复学校2011届高三上学期第三次月考化学试题 题型:058
已知:A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如:被用作某些电池的电解质).
现用A与石墨作电极,B的浓溶液作电解质,构成原电池.有关物质之间的转化关系如下图:(注意:其中有些反应的条件及部分生成物被略去)
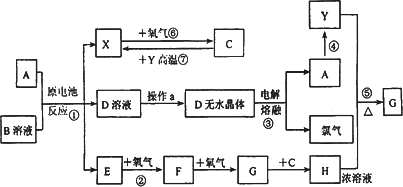
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为________.
(2)从D溶液制备D的无水晶体的“操作a”应在________.
(3)反应②的化学方程式为________.
(4)反应⑤的化学方程式为________.
(5)原电池反应①中正极的电极反应式为________.
查看答案和解析>>
科目: 来源:山东省潍坊市第一中学2011届高三教学质量检测化学试题 题型:058
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现;在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:
Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含________(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含________所致.
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的.
供选用的试剂:
a.酚酞试液
b.CCl4
c.无水酒精
d.KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)结论
氧化性:Br2>Fe3+.故在足量的氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为:________.
(5)实验后的思考:
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先氧化的离子是________(填离子符号).
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有![]() 的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为________.
的Br-被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为________.
查看答案和解析>>
科目: 来源:山东省罗美中学2011届高三11月月考化学试题 题型:058
某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5 mol·L-1盐酸、0.55 mol·L-1NaOH溶液,尚缺少的实验玻璃用品是________、________.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?________(填“能”或“否”),其原因是________.
(3)他们记录的实验数据如下:

已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18 KJ·℃-1·Kg-1,各物质的密度均为1 g·cm-3.
根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:________
(4)若用KOH代替NaOH,对测定结果________(填“有”或“无”)影响.
查看答案和解析>>
科目: 来源:宁夏银川二中2011届高三第三次月考化学试题 题型:058
有一种溶液,其中含有Ag+、Al3+、K+、Mg2+.
(1)向溶液中加入氯化钠溶液,现象为________.
(2)将实验(1)所得溶液过滤,向滤液中加入氢氧化钠溶液至过量,溶液中进行的反应的离子方程式有Mg2++2OHˉ=Mg(OH)2↓、
Al3++3OHˉ=Al(OH)3↓和________.(3)将实验(2)所得的溶液过滤,向滤液中加入过量的盐酸,产生的现象为________,反应的离子方程式有H++OHˉ=H2O、________、和Al(OH)3+3H+![]() Al3++3H2O
Al3++3H2O
(4)检验溶液中有
K+的方法是________,现象是________.查看答案和解析>>
科目: 来源:黑龙江省大庆铁人中学2011届高三上学期期中考试化学试题 题型:058
将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是________,可能有的阳离子是________.(不考虑水电离出的H+,下同)
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是________,可能含有的阳离子是________.
(3)如果反应后的溶液中无金属剩余,则加入金属粉末的最大质量应小于________.
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属粉末的最小质量为________.
查看答案和解析>>
科目: 来源:黑龙江省大庆铁人中学2011届高三上学期期中考试化学试题 题型:058
实验室用稀硝酸与Cu反应来制备NO气体,如果采用图(Ⅰ)装置,由于烧瓶内的空气不易排出,生成的NO很快被氧化成红棕色的NO2,不易观察到有无色的NO生成.即使可用排水法收集到无色的NO,也无说服力,学生会认为NO是由NO2与H2O反应生成的.有人设计了图(Ⅱ)装置,用来做该实验可以达到满意的效果.
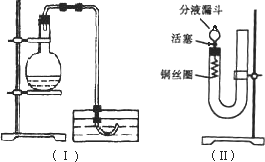
(1)将有关操作补充完全:
①将活塞打开,从U形管的长管口注入稀硝酸,一直注到________为止.
②关闭活塞,用酒精灯在________加热,当________时,立即撤去酒精灯.
(2)回答下列问题:
①反应在什么情况下可以自动停止?可以在何处观察到无色的NO气体?
__________________________;
②如果再将活塞慢慢打开,可立即观察到哪些明显现象?
__________________________;
③如果需要再获得NO与已生成的NO2形成鲜明对照的实验效果,应________(填操作).
查看答案和解析>>
科目: 来源:江苏省泰州中学2011届高三质量调研测试化学试题 题型:058
工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾(FeSO4·7H2O).
(1)若用98%1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1∶________.
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+).则该样品中Fe2+离子的氧化率为________.
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液.现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO![]() +5Cu2S+44H+
+5Cu2S+44H+![]() 10Cu2++5SO2+8Mn2++22H2O
10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+![]() 5Cu2++5SO2+6Mn2++14H2O
5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与V mL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应.已知:MnO![]() +Fe2++H+——Mn2++Fe3++H2O(未配平)
+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为________;
②若V=35,试计算混合物中CuS的质量分数.
查看答案和解析>>
科目: 来源:江苏省泰州南通2010届高三第三次模拟考试化学试题 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:上海市部分重点中学2010届高三第二次联考化学试题 题型:058
工业上用铝土矿(含氧化铝、氧化铁)制取金属铝的生产过程如下框图

请回答下列问题:
(1)写出铝土矿与氢氧化钠溶液反应的离子方程式________.
(2)沉淀C的化学式为________,该物质除了用于金属冶炼以外,还可用作________.电解熔融的氧化铝时,物质α是________,其作用是________.
(3)在实验室中欲从溶液E中得到较纯净的固体NaOH,需要进行的操作顺序是:________、趁热过滤、________、________.
(4)生产过程中,可以循环使用的物质有四种,除NaOH、H2O以外,另外两种物质是________、________(填化学式).
查看答案和解析>>
科目: 来源:上海市部分重点中学2010届高三第二次联考化学试题 题型:058
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
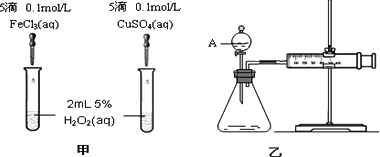
(1)定性分析:如图甲可通过观察________,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是________
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为________,检查该装置气密性的方法是________,实验中需要测量的数据是________.
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
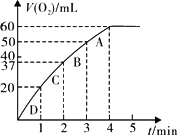
①写出H2O2在二氧化锰作用下发生反应的化学方程式________.
②实验时放出气体的总体积是________
mL.③放出![]() 气体所需时间为________
气体所需时间为________
④反应放出![]() 气体所需时间约为________
气体所需时间约为________
⑤A、B、C、D各点反应速率快慢的顺序为________>________>________>________.
⑥解释反应速率变化的原因________.
⑦计算H2O2的初始物质的量浓度________mol/L.(请保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com