
科目: 来源:海南省嘉积中学2011届高三质量检测(四)化学试题 题型:058
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
![]()
甲同学认为,该溶液的pH升高的原因是HCO![]() 的水解程度增大,故碱性增强,该反应的离子方程式为________.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3.丙同学认为甲、乙的判断都不充分.丙认为:
的水解程度增大,故碱性增强,该反应的离子方程式为________.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3.丙同学认为甲、乙的判断都不充分.丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)判断正确.试剂X是________.
A.Ba(OH)2溶液
B.BaCl2溶液
C.NaOH溶液
D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH________(填“高于”、“低于”或“等于”)8.3,则________(填“甲”或“乙”)判断正确.
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是________.
查看答案和解析>>
科目: 来源:浙江省杭州外国语学校2011届高三11月月考化学试题 题型:058
用下图所示装置进行中和热测定实验,请回答下列问题:
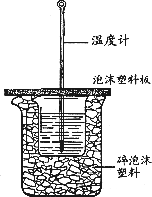
(1)大小烧杯之间填满碎泡沫塑料的作用是________,从实验装置上看,图中缺少的一种玻璃仪器是________.
(2)使用补全仪器后的装置进行实验,取50 mL 0.25 mol/L H2SO4溶液与50 mL 0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容c为4.18J/(g·℃),溶液的密度均为1g/cm3.通过计算可得中和热ΔH=________,H2SO4与NaOH反应的热化学方程式________.
(3)实验中若用60 mL 0.25 mol·L-1 H2SO4溶液跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”、“不相等”),所求中和热________(填“相等”、“不相等”);若用50 mL 0.50 mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会________.
(填“偏大”、“偏小”、“不受影响”)
(4)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1________ΔH(填“<”、“>”或“=”),理由是________.
查看答案和解析>>
科目: 来源:浙江省杭州外国语学校2011届高三11月月考化学试题 题型:058
金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示.
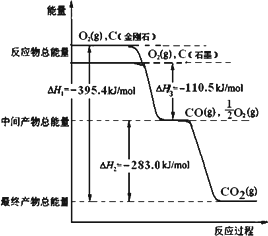
(1)等量金刚石和石墨完全燃烧________(填“金刚石”或“石墨”)放出热量更多,表示石墨燃烧热的热化学方程式________.
(2)在通常状况下,金刚石和石墨________(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式________.
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量________.
查看答案和解析>>
科目: 来源:上海市吴淞中学2011届高三上学期第一次月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:上海市吴淞中学2011届高三上学期第二次月考化学试题 题型:058
| |||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山东省莱芜市2011届高三11月阶段测试化学试题 题型:058
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH+4、Mg2+、Ba2+、Cl-、SO2-4、CO2-3,将该混合物溶于水后得澄清溶液.现取3份100 mL该溶液分别进行如下实验:

试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是________,(填“一定存在”、“一定不存在”或“不能确定”);根据实验1~3判断混合物中一定不存在的离子是________.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):

(3)试通过计算确定K+是否存在,写出计算过程.
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期中考试化学试题 题型:058
有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻.在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁.已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:

请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,该反应的离子方程式为:________.
(2)写出下列化学用语:用电子式表示乙分子的形成过程________,戊分子的结构式是________,甲和丙反应产物的电子式________.
(3)写出下列反应的化学方程式:
丙+丁→D+乙:________;
A+丙→D+甲:________
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期中考试化学试题 题型:058
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下:
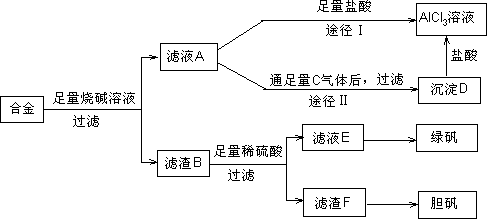
试回答下列问题:
(1)过滤用的器材已有:滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________.
(2)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是________,理由是________.
(3)从滤液E中得到绿矾晶体的实验操作是________.
(4)写出用滤渣F制备胆矾晶体的有关化学方程式________.
(5)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理________,理由是________.
查看答案和解析>>
科目: 来源:黑龙江省牡丹江一中2011届高三上学期期中考试化学试题 题型:058
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4 FeSO4+H2S↑.根据下图中A~D的实验装置和试剂进行实验:
FeSO4+H2S↑.根据下图中A~D的实验装置和试剂进行实验:

(1)装置A是由双孔塞、玻璃导管、________和________组装起来的.
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:
制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%) ![]() Na2SO4+SO2↑+H2O.
Na2SO4+SO2↑+H2O.
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是________.
②C装置中的溶液是________,说明二氧化硫具有________性.
(3)D中产生的现象是________,说明二氧化硫具有________性.
(4)烧杯中发生反应的离子方程式为________.
查看答案和解析>>
科目: 来源:河南省豫南九校2010-2011学年高三第二次联考化学试题 题型:058
已知:A为酸式盐,B为某二价主族金属元素的化合物,其中B的化学式中共有32个电子,常温常压下C、D、F、G、I均呈气态,除G呈红棕色外其他气体均为无色.等物质的量A、B与少量的水充分混合能恰好完全反应.图中反应条件(除高温外)均已略去.
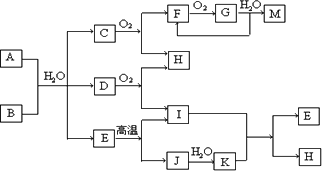
(1)写出B的电子式________.
(2)写出A与B反应的化学方程式________.
(3)写出下列反应的离子方程式:
①在A溶液中加入M________.
②向A溶液中加入过量NaOH溶液,并加热________.
(4)C还可在纯氧中安静燃烧,产物为H和一种单质,写出该反应的化学方程式:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com