
科目: 来源:新人教版2012届高三上学期单元测试(6)化学试题 人教版 题型:058
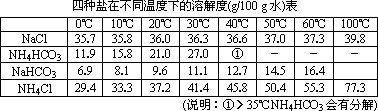
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱.以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置.装置中分别盛有以下试剂:B:稀硫酸;C:盐酸、碳酸钙;D:含氨的饱和食盐水、水

请回答以下问题:
(1)装置的连接顺序应是________(填字母).
(2)A装置中盛放的试剂是________,其作用是________.
(3)在实验过程中,需要控制D温度在30℃~35℃,原因是________.
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体.用蒸馏水洗涤NaHCO3晶体的目的是除去________杂质(以化学式表示)
(5)将锥形瓶中的产物过滤后,所得的母液中含有________(以化学式表示),加入氯化氢,并进行________操作,使NaCl溶液循环使用,同时可回收NH4Cl.
查看答案和解析>>
科目: 来源:新人教版2012届高三上学期单元测试(5)化学试题 人教版 题型:058
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子.有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜.

填写下面空白.
(1)图中标号处需加入的相应物质分别是①________ ③________.
(2)写出①处发生反应的离子方程式________;写出③处发生反应的化学方程式________;
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________;氧化铜________.
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(6)化学试题 题型:058
某无色溶液中可能含有Na+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,依次进行下列实验.观察到现象如下:①用pH试纸检验,溶液pH>7;②向溶液中滴加氯水,无气体产生,再加入CCl4振荡、静置、CCl4层呈橙色,用分液漏斗分液;③向分液后的水溶液中加入Ba(NO3)2和HNO3的混合液,只有白色沉淀,过滤;④在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生.
回答下列问题:
(1)原溶液中肯定含有的离子是 ________;肯定没有的离子是________.
(2)步骤③改用Ba(NO3)2和盐酸的混合液,对判断①有无影响?________.
(3)写出步骤②中的离子方程式 ________.
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(6)化学试题 题型:058
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(5)化学试题 大纲版 题型:058
实验室可由软锰矿
(主要成分为MnO2)制备KMnO4,方法如下:软锰矿和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4.试回答:(1)软锰矿制备K2MnO4的化学方程式是________;
(2)K2MnO4制备KMnO4的离子方程式是________;
(3)若用2.5 g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量:
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是________;
(5)上述制得的KMnO4产品0.165 g,恰好与0.335 g纯Na2C2O4反应.计算该KMnO4的纯度.
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(5)化学试题 大纲版 题型:058
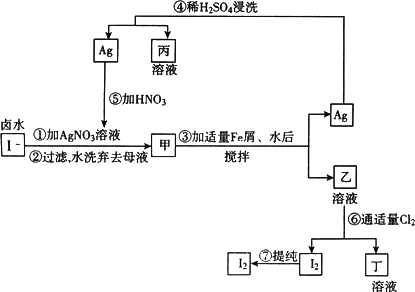
提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下图所示的工艺流程生产单质碘:
试回答:
(1)乙、丁中溶质的化学式:乙________;丁________.
(2)第④步操作中用稀H2SO4浸洗的目的是________(填写字母编号).
a.除去未反应的NO![]()
b.除去未反应的I-
c.除去未反应的Fe
d.除去未反应物质
(3)第⑦步操作可供提纯I2的两种方法是________和________(不要求写具体步骤).
(4)实验室检验I2的方法是________.
(5)甲物质见光易变黑,其反应的化学方程式是________.
(6)反应⑤中所加硝酸应选浓HNO3,还是稀HNO3?________,原因是:________.
查看答案和解析>>
科目: 来源:大纲版2012届高三上学期单元测试(5)化学试题 大纲版 题型:058
在实验室可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
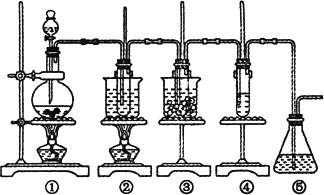
图中:①为氯气发生装置;②的试管中盛有
15 mL 30% KOH溶液,并置于水浴中;③的试管中盛有15 mL 8% NaOH溶液,并置于水浴中;④的试管内加有紫色石蕊试液;⑤为尾气吸收装置.请填写下列各题:(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过________(填写仪器名称)向烧瓶中加入少量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置.
A.碱石灰
B.饱和食盐水
C.浓硫酸
D.氢氧化钠溶液
(2)比较制取氯酸钾与次氯酸钠的条件,二者的差异是________.
(3)本实验中制取次氯酸钠的化学方程式是:________
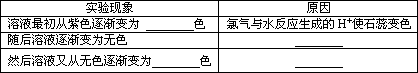
(4)实验中可以观测到④的试管中溶液的颜色发生了变化,请填写下表:
查看答案和解析>>
科目: 来源:上海市南汇中学2012届高三第一次考试化学试题 题型:058
水杨酸是合成阿斯匹林的重要原料.水杨酸的学名邻羟基苯甲酸,结构简式为
![]()
请回答下列问题:
(1)请写出水杨酸中除苯环外具有的官能团________;
(2)请写出与水杨酸互为同分异构体,既属于酚类又属于酯类化合物的结构简式:________.
(3)写出水杨酸与碳酸氢钠反应的化学方程式:________
(4)在一定条件下,水杨酸与乙酸酐可合成阿斯匹林,阿斯匹林可表示为:
![]()
则阿斯匹林的分子式为________;1摩尔阿司匹林完全水解需要氢氧化钠溶液________摩尔.
(5)阿斯匹林药片需要保存在干燥处,受潮的药片易变质不宜服用;检验受潮药片是否变质的试剂是(只选一种试剂即可)________
查看答案和解析>>
科目: 来源:陕西省西安铁一中2011届高三第二次模拟考试化学试题 题型:058
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加人铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加人氨水有白色沉淀生成,继续加人过量氨水,沉淀不消失;
④取溶液少许,滴人氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴人硝酸银溶液产生白色沉淀,再加人过量的稀硝酸,沉淀不消失.
请回答下列问题:
(1)在实验①中,下图所示的操作中正确的是________(填代号).
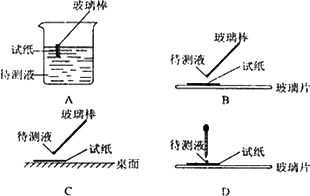
(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子________.
(3)写出与实验②有关的离子方程式:________.
查看答案和解析>>
科目: 来源:湖北省武汉市部分学校2011-2012学年高三新起点调研测试化学试题 题型:058
水是生命之源,它与我们的生活密切相关.在化学实验中,水也是一种常用的试剂.
(1)水分子与H+形成水合氢离子(H3O+)的立体构型为________.
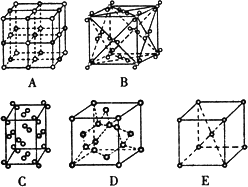
(2)冰是立方面心结构.下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序).上述五种晶体中与冰的晶体类型相同的是________;(填写编号).
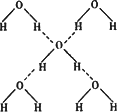
(3)在冰的晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热(即1 mol水由冰转化为水蒸汽所需能量)是51 KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”(破坏1 md氢键所需的能量即为氢键的“键能”)是________KJ kJ/mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com