
科目: 来源:江苏省某重点中学2012届高三10月月考化学试题 题型:058
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
(1)
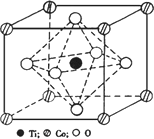
写出基态Mn原子的核外电子排布式________.(2)CoTiO3晶体结构模型如图.在CoTiO3晶体中1个Ti原子、1个Co原子周围距离最近的O数目分别为________个、________个.
(3)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理.O2在其催化作用下,可将CN-氧化成CNO-,进而得到N2.与CNO-互为等电子体的分子、离子化学式分别为________、________(各写一种).
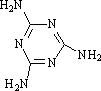
(4)三聚氰胺是一种含氮化合物,其结构简式如图.三聚氰胺分子中氮原子轨道杂化类型是________;1 mol三聚氰胺分子中σ键的数目为________.
查看答案和解析>>
科目: 来源:江苏省某重点中学2012届高三10月月考化学试题 题型:058
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量和结晶水的含量,某实验小组做了如下实验:
(1)铁含量的测定
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250 ml溶液.
步骤二:取所配溶液25.00 ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 ml,滴定中MnO4-,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010 mol/L KMnO4溶液19.98 ml.
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作步骤依次是:称量、________、转移、洗涤并转移、________摇匀.
②加入锌粉的目的是________.
③写出步骤三中发生反应的离子方程式________.
④实验测得该晶体中铁的质量分数为________.在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量________.(选填“偏低”“偏高”“不变”)
(2)结晶水的测定
将坩埚洗净,烘干至恒重,记录质量;在坩埚中加入研细的三草酸合铁酸钾晶体,称量并记录质量;加热至110℃,恒温一段时间,置于空气中冷却,称量并记录质量;计算结晶水含量.请纠正实验过程中的两处错误;________;________.
查看答案和解析>>
科目: 来源:山西省太原五中2012届高三10月月考化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:浙江省杭州十四中2012届高三9月月考化学试题 题型:058
一实验小组的同学查阅了20℃时,一些物质的溶解度数据:
![]()
并做了如下四个实验:
实验一:取氯化钡固体配成饱和溶液,再向其中加入硝酸铵固体至恰好不溶为止.
实验二:向上述溶液中加入一定量氢氧化钠溶液,发现产生大量白色沉淀,并闻到刺激性气体气味.将所得沉淀反复水洗后分成两份.
实验三:向一份沉淀中加入足量稀盐酸.
实验四:向另一份沉淀中加入足量稀硫酸,再加足量稀盐酸.
回答下列问题:
(1)实验二中发生的化学反应的离子方程式为.
(2)实验三中观察到的实验现象为.
(3)实验四中观察到的实验现象为;相关的化学方程式为.
查看答案和解析>>
科目: 来源:河北省正定中学2012届高三第一次考试化学试题 题型:058
一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、
SO42-、CO32-、NO3-、I-,取该溶液进行以下实验:
①用pH试纸测得该溶液呈酸性;
②取部分溶液,加入数滴新制的氯水及少量CCl4,经振荡、静置后,CCl4层呈紫红色;
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,在整个滴加过程中无沉淀生成;
④取部分上述碱性溶液,加入Na2CO3溶液,有白色沉淀生成,
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.
根据上述实验事实确定:
(1)写出②所发生反应的离子方程式________;
(2)该溶液中肯定存在的离子是________;
(3)该溶液中肯定不存在的离子是________.
查看答案和解析>>
科目: 来源:安徽省阜阳一中2012届高三第一次月考化学试题 题型:058
FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
Ⅰ实验需要90 mL 0.1 mol/L FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是________
(2)下列有关配制过程中说法错误的是________(填序号).
a.用电子天平称量质量为1.944 g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90 mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
Ⅱ.探究FeBr2的还原性
取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+.
(1)请你完成下表,验证假设:

若假设1正确,从实验①中分离出Br2的实验操作名称是________;
(2)实验证明:还原性Fe2+>Br-,请用一个离子方程式来证明:________;
(3)若在50 mL上述FeBr2溶液中通入5×10-3 mol Cl2,反应的离子方程式为________.
查看答案和解析>>
科目: 来源:安徽省阜阳一中2012届高三第一次月考化学试题 题型:058
某待测溶液(阳离子为Na+)中可能含有SO42-、SO32-、NO3-、Cl-、Br-、S2-、CO32-、HCO3-中的一种或多种,进行如图所示的实验,每次实验所加试剂均过量,回答以下问题:
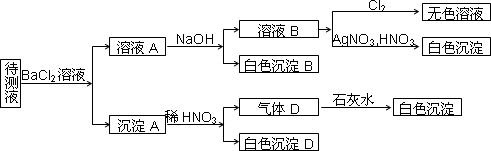
(1)待测液中是否含有SO42-、SO32-:________.
(2)沉淀B的化学式为________;生成沉淀B的离子方程式为________.
(3)根据以上实验,待测液中肯定没有的离子是________;肯定存在的离子还有________.
查看答案和解析>>
科目: 来源:河北省定州二中2012届高三第一次月考化学试题 题型:058
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):
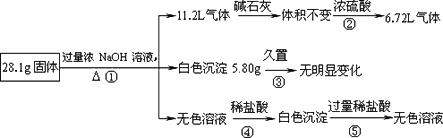
回答下列问题:
(1)混合物中是否存在FeCl2________(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4________(填“是”或“否”),你的判断依据是________
(3)写出步骤①中所有反应的离子方程式:(有几个写几个)
___________________________.
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程)
___________________________.
查看答案和解析>>
科目: 来源:河北省定州二中2012届高三第一次月考化学试题 题型:058
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想:①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含________(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含________所致.
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
a.酚酞试液
b.CCl4
c.无水酒精
d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入1~2滴溴水,溶液呈黄色,所发生的离子反应方程式为________.
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为________.
查看答案和解析>>
科目: 来源:江苏省无锡一中2012届高三9月初检测试题化学试题 题型:058
有一混合溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-,现各取100 mL溶液三份进行如下实验:
①向第一份中加入AgNO3溶液,有白色沉淀产生;
②向第二份中加入足量NaOH溶液后加热,收集到的气体体积为0.896 L(标准状况下);③向第三份中加入足量BaCl2溶液,得到沉淀总质量为6.27 g,沉淀经足量盐酸洗涤后,剩余2.33 g.请回答下列问题:
(1)该溶液中肯定存在的离子有________,肯定不存在的离子有________.
(2)溶液中可能存在的离子是________,为确定该离子是否存在,可采取的实验操作是________
(3)其中肯定存在的离子在原溶液中的物质的量浓度分别为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com