
科目: 来源:江西省师大附中2012届高三上学期期中考试化学试题 题型:058
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:进行微量实验:如图所示,
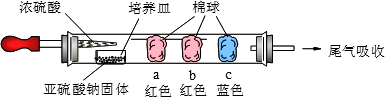
将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,A.B.C三个棉球变化如下表.
请完成下列表格:

查看答案和解析>>
科目: 来源:江苏省无锡市2012届高三上学期期中考试化学试题 题型:058
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4·yCu(OH)2].为了加以验证,小组成员进行了如下实验:
①分别配制50 mL物质的量浓度均为0.100 mol·L-1 CuSO4溶液和NaOH溶液;
②准确量取10 mL CuSO4溶液倒入50 mL烧杯中;
③向烧杯中匀速加入0.100 mol·L-1 NaOH溶液,并每加入1.00 mL NaOH溶液用pH计测一次混合溶液的pH;
④当滴人NaOH溶液的体积达到30 mL时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时pH变化曲线.

请回答以下问题:
(1)V(NaOH)在0.00 mL~2.00 mL之间时,溶液中无沉淀产生,但pH变化较快的原因是________;
(2)V(NaOH)在2.00 mL~15.00 mL之间时,溶液中产生绿色沉淀,并不断增加,经检测此沉淀为碱式硫酸铜.已知蒸馏水的pH为6.32,当V(NaOH)为15.00 mL时,溶液pH为6.30,则可求得x=________,y=________;
(3)V(NaOH)在17.00 mL~20.00 mL之间时,溶液中出现蓝色沉淀,并不断增加.已知V(NaOH)为20.00 mL时,溶液pH为12.25,则此时沉淀中________(填“含”或“不含”)有碱式硫酸铜,理由是________.
查看答案和解析>>
科目: 来源:江苏省无锡市2012届高三上学期期中考试化学试题 题型:058
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO2-4'等杂质离子,实验室提纯NaCl的流程如下:
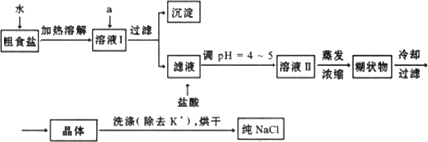
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO2-4离子,选出a所代表的试剂,按滴加顺序依次为________(填化学式);滤液中滴加盐酸调pH=4~5的目的是________;
②选用75%乙醇洗涤除去NaCl晶体表面附带的少量KCl,检验NaCl是否洗净的操作是________;
(2)用提纯的NaCl配制480 mL 4.00 mol·L-1 NaCl溶液,需要称取的质量为________g,所用仪器除药匙、玻璃棒、烧杯外还有________(填仪器名称);
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2 L,主要原因是________.

查看答案和解析>>
科目: 来源:山西省太原市2012届高三第一学段测评考试化学试题 题型:058
某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质.过程如下:
[提出问题]
①在周期表中,Cu、Al位置接近.Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
(1)解决问题①需用到的药品有CuSO4溶液、________、________(填试剂名称),同时进行相关实验.
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80-100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A.冷却后称量,A的质量为72 g,则A的化学式为________.向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在.
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
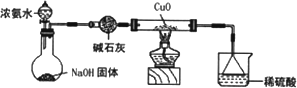
实验中观察到CuO变为红色物质.查资料可知,同时生成一种无污染的气体.
[实验结论]
(1)Cu(OH)2具有两性.证明Cu(OH)2具有两性的实验现象是________.
(2)根据实验方案(2),得出的+1价Cu相+2价Cu稳定性大小的结论是:在高温时________.在酸性溶液中________.
(3)CuO能够被NH3还原.
[问题讨论]
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物.请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
查看答案和解析>>
科目: 来源:山西省太原市2012届高三第一学段测评考试化学试题 题型:058
某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物.
已知:氯气和碱的反应为放热反应.温度较高时,氯气和碱还能发生如下反应:
3C12+6OH- 5C1-+ClO3+3H2O.该兴趣小组设计了下列实验装置,进行实验.
5C1-+ClO3+3H2O.该兴趣小组设计了下列实验装置,进行实验.

请回答下列问题:
(1)甲装置中发生反应的化学方程式是________,乙装置的作用是________.
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值.他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高是可能原因.为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应).

①图中曲线Ⅰ表示________离子的物质的量随反应时间变化的关系.
②所取石灰乳中含有Ca(OH)2的物质的量为________mol.
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:________.
查看答案和解析>>
科目: 来源:湖北省荆州中学2012届高三第二次质量检查化学试题 题型:058
海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案

已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;
Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12.
请回答下列问题.
(1)沉淀物X为________.
(2)滤液M中存在的阳离子有________.
(3)滤液N中存在的阳离子有________.
(4)步骤②中若改为加入8.0 g NaOH固体,沉淀物Y为________.
查看答案和解析>>
科目: 来源:湖北省荆州中学2012届高三第二次质量检查化学试题 题型:058
金属元素锡(Sn)和碳元素位于同一主族,主要化合价为+2和+4.某同学通过下列方法测定金属锡样品的纯度:(假定杂质不参加反应)
(1)将试样溶于盐酸中,反应的化学方程式为:________.
(2)加入过量的FeCl3溶液,反应的化学方程式为:________.
(3)用已知浓度的K2Cr2O7酸性溶液滴定生成的Fe2+.反应的离子方程式为:________.
(4)现有金属锡样品1.142 g,经上述各步反应后,共用去0.100 mol/L的K2Cr2O7溶液16.0 ml.则试样中锡的质量分数?________.
(5)步骤(4)中如果取用16.00 ml的K2Cr2O7溶液则应用________(填仪器名称).该同学在配制0.100 mol/L的试验中,若其他步骤都正确,但定容时俯视刻度线则所得溶液的浓度________(填偏高,偏低,或无影响)
查看答案和解析>>
科目: 来源:浙江省东阳中学高三10月阶段性考试化学试题 题型:058
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.

回答下列问题:
(1)A中加入的固态混合物是________,发生反应的化学方程式是________;
(2)B中加入的物质是________,其作用是________;
(3)实验时在观察到C中的现象是________,发生反应的化学方程式是________;
(4)实验时在D中观察到的现象是________,D中收集到的物质是________,检验该物质中的某一种物质的方法和现象是________.
查看答案和解析>>
科目: 来源:浙江省东阳中学高三10月阶段性考试化学试题 题型:058
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.

(1)加热前通入空气的目的是________,操作方法为________.
(2)装置A、C、D中盛放的试剂分别为A________,C________,D________.
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将________(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将________;若撤去E装置,则测得Na2CO3·10H2O的含量________.
(4)若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中NaHCO3质量分数为________(用含w、m1、m2的代数式表示).
查看答案和解析>>
科目: 来源:陕西省师大附中2012届高三10月月考化学试题 题型:058
某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-.为了鉴别这些离子,分别取少量溶液进行以下实验:
①所得溶液呈碱性;
②加HCl后,生成无色无味的气体.该气体能使饱和石灰水变浑浊.
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色.
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量的盐酸,沉淀不能完全溶解.
⑤加HNO3酸化后,再加过量的AgNO3,溶液中析出白色沉淀.
(1)分析上述5个实验,写出每一实验鉴定离子的结论与理由.
实验①________.
实验②________.
实验③________.
实验④________.
实验⑤________.
(2)上述5个实验不能确定是否的离子是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com