
科目: 来源:山东省济宁一中2012届高三第三次定时练习化学试题 题型:058
用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)
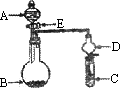
(1)若A中为30%的H2O2溶液,B中固体为MnO2,C中盛有FeCl2和KSCN的混合液,旋开E后,发现C中溶液变为红色,写出C中发生氧化还原反应的离子方程式________.
(2)若A中装有浓盐酸,B中装有固体KMnO4,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体,已知1 mol KMnO4发生反应时转移5 mol电子.则B中发生反应的化学方程式________,C中的现象是________.
(3)若B中是生石灰,将A中液体逐滴加入B内,C中盛有铝盐溶液,实验中观察到C溶液中出现白色沉淀,最终沉淀也未溶解.C中发生反应的离子方程式为________.
查看答案和解析>>
科目: 来源:福建省福州八县(市)一中2012届高三上学期期中联考化学试题 题型:058
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式.
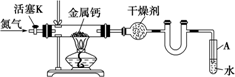
(1)若装置中不用U型管,实验也能顺利进行,原因是:________
(2)反应过程中末端导管必须始终插入试管A的水中,目的是①便于观察N2的流速,②________
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,熄灭酒精灯,________④拆除装置,取出产物.
(4)数据记录如下:
①空瓷舟质量m0/g;
②瓷舟与钙的质量m1/g;
③瓷舟与产物的质量m2/g
①计算得到实验式CaxN2,其中x=________(用m0、m1、m2表示)
②若通入的N2中混有少量O2,理论值比实际测得x值________(填“偏大”或“偏小”)
查看答案和解析>>
科目: 来源:江西省临川一中、新余四中2012届高三上学期期中考试化学试题 题型:058
金属元素锡(Sn)和碳元素位于同一主族,主要化合价为+2和+4.某同学通过下列方法测定金属锡样品的纯度,步骤如下:(假定杂质不参加反应)
(1)将试样溶于盐酸中,反应的化学方程式为:________.
(2)在(1)反应后的溶液中加入过量的FeCl3溶液,反应的化学方程式为:________.
(3)用已知浓度的K2Cr2O7酸性溶液滴定生成的Fe2+.反应的离子方程式为:________
(4)现有金属锡样品1.142 g,经上述各步反应后,共用去0.100 mol/L的K2Cr2O7溶液16.0 ml.则试样中锡的质量分数?________
(5)步骤(4)中如果取用16.00 ml的K2Cr2O7溶液则应用________(填仪器名称).该同学在配制0.100 mol/L K2Cr2O7溶液的试验中,若其他步骤都正确,但定容时俯视刻度线则所得溶液的浓度________(填偏高,偏低,或无影响)
查看答案和解析>>
科目: 来源:山西省忻州一中2012届高三上学期期中考试化学试题 题型:058
以下是有关SO2、Cl2的性质实验.
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质.
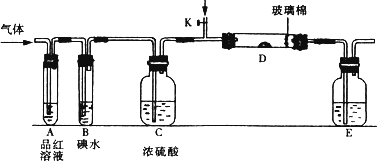
若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?________(填“相同”或“不相同”);若装置D中装的是V2O5(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为________.
(2)若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生.写出Cl2与含X的溶液反应的离子方程式________.
(3)将0.23 mol SO2和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应,在一定温度下,反应达到平衡,得到0.12 mol SO3.则反应的平衡常数K=________.若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度________.(填“填大”、“不变”或“减小”),氧气的转化率________(填“升高”、“不变”或“降低”).
查看答案和解析>>
科目: 来源:山西省忻州一中2012届高三上学期期中考试化学试题 题型:058
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节.某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
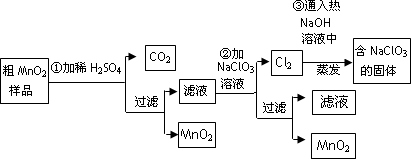
(1)第①步加稀H2SO4时,粗MnO2样品中的________(写化学式)转化为可溶性物质.
(2)第②步反应的离子方程式是:
________ ________+________ClO3-+________ ________=________MnO2↓+Cl2↑+________ ________;反应中氧化剂是________.
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、________、________、玻璃棒.
(4)
已知2H2O2(l)=2H2O(l)+O2(g) ΔH=a kJ·mol-1反应过程的能量变化如图所示.则
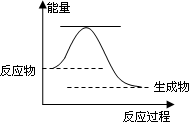
①该反应为________反应(填“吸热”或“放热”).
②请用虚线在图中画出使用MnO2作催化剂的情况下反应过程中体系能量变化示意图.
查看答案和解析>>
科目: 来源:山西省忻州一中2012届高三上学期期中考试化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山东省泰安市2012届高三上学期期中考试化学试题 题型:058
某固体混合物可能由Al、(NH4)2SO4、MgCl2、AlCl3、CuCl2中的一种或几种组成,现对该混合物作如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):

回答下列问题:
(1)混合物中是否存在CuCl2________(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4________(填“是”或“否”),你的判断依据是________.
(3)写出反应③中的离子方程式________.
(4)请根据计算结果判断混合物中是否含有AlCl3(说出你的计算依据,不要求写计算过程).________.
查看答案和解析>>
科目: 来源:山东省泰安市2012届高三上学期期中考试化学试题 题型:058
某校化学研究性学习小组对浓硫酸与金属锌的反应进行探究.首先按图组装好实验装置,然后取一定量的浓硫酸与足量Zn充分反应,微热试管A,实验过程中先观察到C、D中均有气泡产生,D中开始出现浑浊,后浑浊消失,随后气泡量逐渐减少,品红溶液褪色,反应较长时间后,C、D中的气泡量又会明显增加.
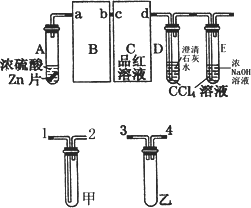
试回答:
(1)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接________、________接b,c接________、________接d;
(2)D、E试管中CCl4溶液的作用是防止溶液倒吸,该实验中起到同样作用的装置是________;
(3)能证明浓硫酸具有强氧化性的实验现象为________;
(4)反应较长时间后气泡量又会明显增加的原因是________;
(5)D中浑浊消失的离子方程式为________.
查看答案和解析>>
科目: 来源:山东省泰安市2012届高三上学期期中考试化学试题 题型:058
下图是某学生设计的制取和收集某些气体的实验装置(可加热).

(1)该装置在加入反应物前,应首先进行的实验操作是________.
(2)下列气体的制取中,若用排空气法收集,可使用该装置制备和收集的是(选填编号,下同)________若用排水法收集(集气瓶中充满水),可使用该装置制备和收集的是________.
①用Zn与稀盐酸反应制H2
②用CaCO3与稀盐酸反应制CO2
③用固体NaOH和浓氨水制NH3
④用Cu与稀HNO3反应制NO
⑤用MnO2与双氧水反应制O2
⑥浓硫酸与铜片反应制SO2
⑦用MnO2与浓盐酸反应制Cl2
查看答案和解析>>
科目: 来源:安徽省淮南市二中2012届高三第三次月考化学试题 题型:058
在已经提取氯化钠、溴、镁等化学物的富碘卤水中,采用下图所示的工艺流程生产单质碘.
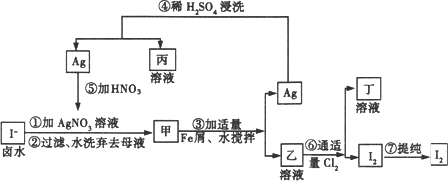
回答下列问题:
(1)写出乙中溶质的化学式乙________.
(2)第④步操作中的用稀H2SO4的浸洗的目的是________(填写字母编号).
A.除去未反应的![]()
B.除去未反应的I-
C.除去未反应的Fe
D.除去碱性物质
(3)若向含1 moL乙的溶液中通入标准状况下氯气11.2 L反应的离子方程式为:________.
(4)第⑦步操作可供提纯I2的两种方法是________和________(不要求写具体步骤).
(5)实验室检验I2的方法是________.
(6)甲物质见光易变黑,其原因是(用化学方程式表示)________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com