
科目: 来源:62A22340_浙江省五校2012届高三第一次联考化学试题.doc 题型:058
(1)
在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)
①该反应的化学平衡常数的表达式K=________,由上表数据可得,该反应为________反应.(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)=0.01 mol·L-1、c(H2O)=0.03 mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,则反应开始时,H2O的消耗速率比生成速率________(填“大”、“小”或“不能确定”)
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为________.
(2)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+
CH3OH(g)+

①平衡时CH3OH的体积分数w为________.
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下.下列说法正确的是________

A.2C1>C3
B.x+y=49.0
C.2P2<P3
D.(a1+a3)<1
E.2P1>P3
F.a1=a2
③
在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)查看答案和解析>>
科目: 来源:江苏省泗阳中学2012届高三第一次调研考试化学试题(普通班) 题型:058
茶是我国人民喜爱的饮品.某校化学兴趣小组的同学设计以下实验来定性检验茶叶中含有Ca、A1、Fe三种元素.
查阅部分资料:草酸铵[(NH4)2C2O4]属于弱电解质;Ca、A1、Fe完全沉淀的pH:Ca(OH)2:pH≥13;A1(OH)3;pH≥5.5;Fe(OH)3:pH≥4.1)
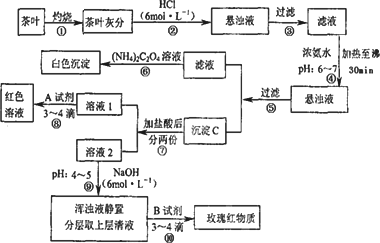
试根据上述过程及信息填空:
(1)步骤④用浓氨水调节pH后,加热至沸30 min的作用是________.
(2)写出检验Ca2+的离子方程式________.
(3)写出沉淀C所含主要物质的化学式________.
(4)写出步骤⑧用A试剂生成红色溶液的离子方程式________.
(5)步骤⑨的作用是________,猜测步骤⑩的目的是________.
查看答案和解析>>
科目: 来源:江苏省泗阳中学2012届高三第一次调研考试化学试题(普通班) 题型:058
A-H及X均为中学化学常见物质,X是一种金属单质,A、B是两周期表中相邻元素,且A在常温下为气体.它们在一定条件下有如下转化关系(图中条件均已略去)
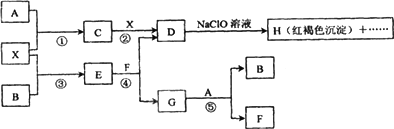
试回答下列问题:
(1)写出C物质的化学式________;G物质的电子式:________.
(2)在上述①-⑤反应中肯定不属于氧化还原反应的是________(填编号);
(3)用离子方程式表示在D溶液中加入NaClO溶液产生红褐色沉淀的原因:________.
(4)请写出C腐蚀铜板制印刷电路板的离子方程式:________.
(5)写出③反应的化学方程式:________.
查看答案和解析>>
科目: 来源:江苏省泗阳中学2012届高三第一次调研考试化学试题(普通班) 题型:058
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题.
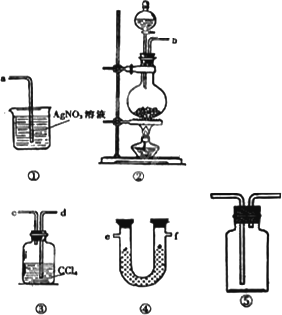
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
b接________,________接________,________接a.
(2)U形管中所盛试剂的化学式为________.
(3)装置③中CCl4的作用是________.
(4)乙同学认为甲同学实验中有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出在某两个装置之间再加装置⑤.你认为装置⑤应加在________之间(填装置序号).瓶中可以放入________.
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液.你认为可将溶液换成________,如果观察到________的现象,则证明制Cl2时有HCl挥发出来.
查看答案和解析>>
科目: 来源:江苏省泗阳中学2012届高三第一次调研考试化学试题(普通班) 题型:058
有一瓶澄清透明溶液
,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、HCO3-
、NO3-、C1-中的一种或几种.取该溶液进行以下实验:(1)溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)取部分溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成;
(3)取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀;
(4)将(3)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀;
(5)另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程先看到生成沉淀,随之沉淀部分溶解,并呈红褐色.
根据上述实验事实确定:在该溶液中肯定存在的离子是________,肯定不存在的离子是________,不能确定是否存在的离子是________.
查看答案和解析>>
科目: 来源:江苏省泗阳中学2012届高三第一次调研考试化学试题(普通班) 题型:058
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:江苏省南京市四校2012届高三12月月考化学试题 题型:058
某研究小组以苯甲醛为原料,制备苯甲酸和苯甲醇.反应原理如下:

有关物质的部分物理性质如下:

实验步骤:
(1)在250 mL锥形瓶中,放入9 g KOH和9 mL水,配成溶液,冷却至室温.加入10.5 g新蒸馏的苯甲醛,塞紧瓶塞,用力振荡,使之变成糊状物,放置24 h.
①苯甲醛要求新蒸馏的,否则会使________(填物质名称)的产量相对减少.
②用力振荡的目的是________.
(2)分离苯甲醇
①向锥形瓶中加入30 mL水,搅拌,使之完全溶解.冷却后倒入分液漏斗中,用30 mL乙醚萃取苯甲醇(注意留好水层).30 mL 乙醚分三次萃取的效果比一次萃取的效果________(填“好”或“差”).
②将醚层依次用饱和亚硫酸氢钠溶液、饱和碳酸钠溶液和水各5 mL洗涤,再用无水硫酸镁干燥.将干燥后的乙醚溶液转移到100 mL蒸馏烧瓶中,投入沸石,连接好普通蒸馏装置,加热蒸馏并回收乙醚,应选择的加热方法是________(填字母代号).
A.水浴加热
B.油浴加热
C.沙浴加热
D.用酒精灯直接加热
③改用空气冷凝管蒸馏,收集________℃的馏分.
(3)制备苯甲酸
在乙醚萃取过的水溶液中,边搅拌边加入浓盐酸酸化至pH=3.5左右.冷却使结晶完全,抽滤,洗涤、干燥.抽滤完毕或中途停止抽滤时,应先________.
查看答案和解析>>
科目: 来源:辽宁省铁岭高级中学2012届高三第一学期期中考试化学试题 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:福建省四地六校2012届高三上学期第三次月考化学试题 题型:058
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质.
(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) ΔH>0
2Fe(s)+3CO2(g) ΔH>0
①该反应的平衡常数表达式为:K=________.
②该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11
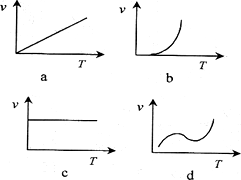
.2 g.则10 min内CO的平均反应速率为________.(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应.下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是________.
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性.但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:
________Fe(OH)3+________ClO-+________□=________FeO42-+________Cl-+________□;
(4)若将a g Fe和Al的混合物溶于2 mol/L的足量的硫酸中,再往溶液中加入足量的6 mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为________.
查看答案和解析>>
科目: 来源:福建省四地六校2012届高三上学期第三次月考化学试题 题型:058
下图所示是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
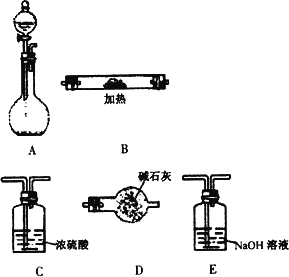
(1)若烧瓶中盛装锌片,分液漏斗中盛装稀硫酸,则:
①当仪器连接顺序为A→C→B→B→D时,两次使用B装置,其中所盛的药品依次是CuO、无水CuSO4粉末.此实验的目的是________.D装置的作用是________.
②为了使B中CuO反应充分,在不改变现有药品的条件下,可采取的方法有(写一种)________.
③加热前必须进行的操作是________.
(2)若烧瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,则:
①烧瓶内产生的气体主要有(写化学式)________.
②用产生的气体做氨的催化氧化实验,各仪器装置按气流方向从左到右连接顺序是(填字母)( )→( )→( )→E
③试管B中的反应方程式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com