
科目: 来源:湖北省黄冈中学2012届高三上学期期中考试化学试题 题型:058
在K2Cr2O7+HCl-KCl+CrCl3+Cl2↑+H2O反应中.
(1)氧化剂是________,________元素被氧化,氧化产物是________.
(2)在参加反应的盐酸中,被氧化的HCl与未被氧化的HCl的质量比为________.
(3)如果反应生成0.1 mol Cl2,则转移电子的数目为:________.
查看答案和解析>>
科目: 来源:湖北省黄冈中学2012届高三上学期期中考试化学试题 题型:058
为测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2 g以下图所示装置进行实验:(铁架台、铁夹等仪器未在图中画出)

(1)将仪器连接好以后,必须进行的第一步操作是________.
(2)此实验还必须用到的最重要的仪器是________;仪器F的作用是________.
(3)已知仪器C中装有品红溶液,其作用是________,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是________.
(4)实验室中备有以下常用试剂:
a.浓硫酸
b.品红溶液
c.酸性高锰酸钾溶液
d.饱和碳酸氢钠溶液
e.氢氧化钠溶液
f.无水硫酸铜
g.碱石灰
h.五氧化二磷
i.无水氯化钙
①请将下列容器中应盛放的试剂序号填入相应空格:
B中________,D中________,E中________.
②实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气.这样做的目的是________.所通空气应先经过________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值________(填“偏高”、“偏低”或“没影响”).
(5)若仪器E在试验完成时增重4.4 g,则Na2CO3与Na2SO3的物质的量之比为________.
查看答案和解析>>
科目: 来源:湖北省黄冈中学2012届高三上学期期中考试化学试题 题型:058
中学课本中常见的几种气体:
①O2
②H2
③CO2
④Cl2
⑤H2S
⑥SO2
⑦NH3都要求掌握其实验室制法.根据所学知识回答有关问题(填气体编号)
(1)能用启普发生器制备的气体有________.
(2)能用浓H2SO4干燥的气体有________.
(3)能用碱石灰干燥的气体有________.
(4)收集气体的方法常有:排水法、向上排空气法和向下排空气法.如下图,用仪器A、B和橡胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外,不能选用其它试剂)正确的操作步骤是________.
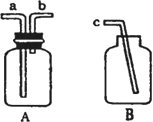
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
“实验化学”
为测定抗贫血药物复方硫酸亚铁中铁的含量,某化学学习小组进行了以下实验研究.
[实验原理]有些溶液本身无色,但加入其他试剂后会有明显的颜色,溶液颜色的深浅和浓度有关,通过比较颜色的深浅可测定物质的含量.
[实验用品]2.00×10-2 mol/L Fe3+的标准溶液、蒸馏水、5% KSCN溶液、pH=4的HAc-NaAc缓冲溶液、1∶1 HNO3溶液、复方硫酸亚铁药片.
铁架台(铁夹)、100 mL容量瓶、胶头滴管、量筒、烧杯、三脚架、石棉网、酒精灯、玻璃棒、25 mL比色管、pH试纸.
[实验过程]
(1)配制系列标准溶液:分别量取2.00×10-2 mol/L Fe3+的标准溶液6.00 mL、6.50 mL、7.00 mL、7.50 mL置于4支25 mL比色管中,再加入1.0 mL 5%KSCN溶液和2.5 mL pH=4的HAc-NaAc缓冲溶液,加蒸馏水稀释至刻度.
(2)制取待测液:取1片复方硫酸亚铁药片,准确称量其质量,置于50 mL烧杯中,加入2 mL蒸馏水溶解,再加入2 mL 1∶1 HNO3溶液,小心加热2~3 min.冷却后,全部移入100 mL容量瓶中,再加入4.0 mL 5%KSCN溶液和10.0 mL pH=4的HAc-NaAc缓冲溶液等,振动、定容、摇匀制得待测液100 mL.取25.00 mL待测液加入与(1)相同规格的比色管中.
(3)比色:将(2)所得比色管中的溶液与(1)各比色管中的溶液进行比较,确定待测液中Fe3+的浓度范围.
请回答下列问题:
(1)在含有Fe3+的溶液中加入KSCN溶液,溶液显________色.
(2)完成该实验,还缺少的仪器有________、________.
(3)加入pH=4的HAc-NaAc缓冲溶液的目的是________.
(4)实验中量取 HNO3溶液、HAc-NaAc缓冲溶液量筒即可,原因是________.
(5)标准溶液的浓度过大或过小均对实验结果有影响,则浓度过小对实验结果造成的影响是________.
(6)若测得待测液中Fe3+的物质的量浓度为cmol/L,药片的质量为m,则药片中铁元素的质量分数为________.
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
“物质结构与性质”
下表为长式周期表的一部分,其中的字母代表相应的元素.
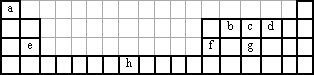
试回答下列问题:
(1)元素h的二价阳离子的基态电子排布式为________.
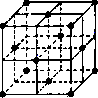
(2)在1185 K时,元素h可形成如图所示基本结构单元的晶体,则其中h原子的配位数是________.
(3)c、d、e、f元素的第一电离能(I1)由小到大的顺序为________.(用相应元素符号表示)
(4)表中所列的元素之间可以形成多种化合物,其中邻羟基苯甲醛的沸点低于对羟基苯甲醛的沸点,理由是________.邻甲基苯甲醛分子中碳原子轨道的杂化类型为________.1 mol苯甲醛分子中σ键为________mol.
(5)一种由表中元素形成的离子与单质d3互为等电子体,其化学式为________.
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.

(1)电解饱和食盐水的化学方程式为________.
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2.24 L.(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)
①理论上,电解后溶液的pH=________.
②若实际测得反应后溶液的pH=13.00,则造成这种误差的原因可能是:
a.氯气和氢氧化钠溶液反应
b.还可能为(用化学方程式表示):________.
若是原因b,则电解过程中溶液减小的质量是________.
(3)若溶液实际减少的质量为4.23 g,则所产生的气体的物质的量之比是多少?
(写出计算过程)
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
某硝酸厂附近的空气主要污染物为氮的氧化物.为了保护环境和综合利用,可采用氨-碱两级吸收法.此法兼有碱吸收和氨吸收两法的优点,其吸收工艺流程如下:
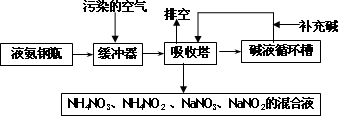
(1)排空物质的主要成分为________.
(2)进入吸收塔以前加一个缓冲器的目的是________.
(3)从吸收塔排出的混合液用途之一为________.
空气的主要污染物为硫的氧化物和氮的氧化物.研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:
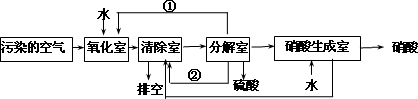
各室中发生的反应如下:
a.氧化室:NO2(g)+SO2(g)+H2O(l)![]() H2SO4(l)+NO(g) ΔH=akJ·mol-1
H2SO4(l)+NO(g) ΔH=akJ·mol-1
b.清除室:NO(g)+NO2(g)=N2O3(g) ΔH=b kJ·mol-1
N2O3(g)+2H2SO4(l)![]() 2NOHSO4(s)+H2O(l) ΔH=c kJ·mol-1
2NOHSO4(s)+H2O(l) ΔH=c kJ·mol-1
c.分解室:4NOHSO4(s)+O2(g)+2H2O(l)![]() 4H2SO4(l)+4NO2(g) ΔH=d kJ·mol-1
4H2SO4(l)+4NO2(g) ΔH=d kJ·mol-1
回答下列问题:
(4)①和②分别为(写化学式)________、________.
(5)写出SO2、O2和H2O反应生成H2SO4的热化学方程式:________.
查看答案和解析>>
科目: 来源:江苏省苏北四市2012届高三第一次调研测试化学试题 题型:058
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如下图实验装置.

依据实验设计,请回答:
(1)装置中盛装稀硫酸的仪器名称是________;装置D的作用是________.
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为________.
(3)若不考虑操作、药品及其用量等方面的影响,该实验测得结果会________(填“偏高”、“偏低”、“无影响”);
原因是________(你若认为无影响,该空不用回答).
查看答案和解析>>
科目: 来源:安徽省省城名校2012届高三上学期第四次联考化学试题 题型:058
某化学兴趣小组同学,用下列各仪器装置制取乙烯,并用过量的氧气将C2H4氧化成CO2和H2O,测定乙烯中碳、氢两种元素的质量比.
回答下列问题:
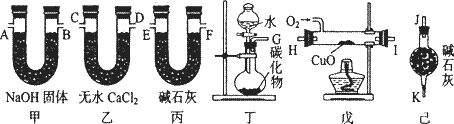
(1)该同学受实验室制备C2H2的启发,拟从CaC2、ZnC2、Al4C3、Mg2C2、Li2C2中选择一种试剂与水反应来制备乙烯,写出该反应的化学方程式:_________.
(2)若产生的气体由左向右流向,各装置导管的连接顺序是:G接E、F接_________、_________接_________、_________接A、B接J.
(3)装置甲的作用是_________;
装置己的作用是_________.
(4)装置戊中CuO的作用是_________.
(5)实验前称得甲、乙两装置的质量分别为m1 g和n1 g,实验完毕,称得甲、乙两装置的质量分别变为m2 g和n2 g,则乙烯分子中碳原子和氢原子的原子个数比为_________(列出算式).
(6)若戊中没有CuO,则测定结果_________(填“偏高”、“偏低”或“不变”,下同);若不接丙装置,则测定结果_________.
查看答案和解析>>
科目: 来源:湖南省澧县一中、岳阳县一中2012届高三11月联考化学试题 题型:058
固态化合物A由两种短周期元素组成,可与水发生复分解反应,甲组同学用下图装置(夹持装置略)对其进行探究实验.

(1)仪器B的名称是________.
(2)实验中,Ⅱ中的试纸变蓝,Ⅳ中黑色粉末逐渐变为红色并有气体M生成,则Ⅳ发生反应的化学方程式为________;Ⅲ中的试剂为________.
(3)乙组同学进行同样实验,但装置连接顺序为Ⅰ——Ⅲ——Ⅳ——Ⅱ——Ⅴ,此时Ⅱ中现象为________,原因是________.
(4)经上述反应,2.5 g化合物A理论上可得0.56 L(标准状况)M;则A的化学式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com