
科目: 来源:陕西省交大附中2012届高三第四次诊断化学试题 题型:058
某课外活动小组同学用下图装置进行实验,试回答下列问题.

(1)若开始时开关K与b连接,则B极的电极反应式为________.总反应的离子方程式为________.
有关上述实验,下列说法正确的是(填序号)________.
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为________.
查看答案和解析>>
科目: 来源:陕西省西安中学2012届高三第三次月考化学试题(重点班) 题型:058
A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1 mol·L-1C与D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)D是________,E是________;
(2)用水稀释0.1 mol·L-1B时,溶液中随着水量的增加而减小的是________(填写序号)
a.![]()
b.
c.c(H+)·c(OH-)
d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E
d.E溶液里有锌粉剩余
(4)室温下,向0.01 mol·L-1C溶液中滴加0.01 mol·L-1D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三4月双周练习(一)化学试题 题型:058
NaClO2用于棉、麻、粘胶纤维及织物的漂白.实验室制备NaClO2的装置如下图所示:
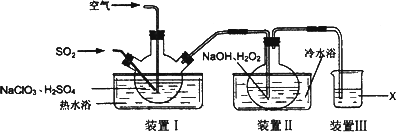
(1)装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应结束后通入适量的空气,其目的是________.
(2)装置Ⅱ中反应生成NaClO2的化学方程式为________.反应后的溶液中阴离子除了ClO![]() 、ClO
、ClO![]() 、Cl-、ClO-、OH-外还可能含有的一种阴离子是________,检验该离子的方法是________
、Cl-、ClO-、OH-外还可能含有的一种阴离子是________,检验该离子的方法是________
(3)已知在NaClO2饱和溶液中温度低于38℃时析出晶体是NaClO2·3H2O,温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl.请补充从装置Ⅱ反应后的溶液中获得NaClO2晶体的操作步骤.
①减压,55℃蒸发结晶;②________;③________;④________;得到成品.
(4)装置Ⅲ中试剂X为________.
查看答案和解析>>
科目: 来源:2006年普通高等学校招生全国统一考试上海卷化学 题型:058
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如下
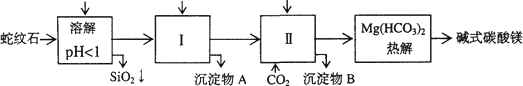
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________
(2)进行Ⅰ操作时,控制溶液pH=7-8(有关氢氧化物沉淀的pH见下表)
Ca(OH)2不能过量,若Ca(OH)2过量可能会导致________溶解、________沉淀.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入________(填入物质的化学式),然后________(依次填写实验操作名称).
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是________(填写物质化学式).
(5)现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量
②高温分解
③________
④________
⑤MgO称量
(6)18.2 g产品完全分解后,产生6.6 g CO2和8.0 g MgO,由此可知,产品的化学式中:a=________ b=________ c=________
查看答案和解析>>
科目: 来源:山东省济宁市梁山二中2012届高三12月月考化学试题 题型:058
| |||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山东省济宁市梁山二中2012届高三12月月考化学试题 题型:058
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数.

(1)实验时,B中发生反应的化学方程式为________,________.
(2)装置C、D中盛放的试剂分别为:
C________,D________(供选试剂为:浓硫酸、无水CaCl2、碱石灰)
(3)E装置中的仪器名称是________,它在该实验中的主要作用是________.
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将________(填“偏高”、“偏低”或“无影响”).
(5)若样品的质量为m g,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3·10H2O的质量分数为:________(结果用分数表示,可不化简).
查看答案和解析>>
科目: 来源:湖北省襄阳五中2012届高三上学期期中考试化学试题 题型:058
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀.甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数.
(1)按照甲同学的观点,发生反应的离子方程式为________
(2)两同学利用下图所示装置进行测定

①在研究沉淀物组成前,须将沉淀从溶液中分离并净化.具体操作依次为过滤、洗涤、干燥.
②装置E中碱石灰的作用是________.
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同)________.若未进行步骤________,将使测量结果偏低.
④若沉淀样品的质量为m g,装置D的质量增加了n g,则沉淀中CuCO3的质量分数为________.
(3)丙同学认为还可以通过测量CO2的体积或测量________来测定沉淀中CuCO3的质量分数.
查看答案和解析>>
科目: 来源:福建省福州三中2012届高三第二次月考化学试题 题型:058
实验室需要0.10 mol/L NaOH溶液475 mL和0.40 mol/L.硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
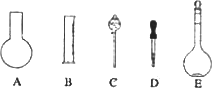
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称).
(2)人们常将配制过程简述为以下各步骤:
A.冷却
B.称量
C.洗涤
D.定容
E.溶解
F.摇匀.
G.移液
其正确的操作顺序应是________(填各步骤序号).
(3)计算该实验用托盘天平称取NaOH的质量为________g.在实验中其他操作均正确,若定容时俯视视刻度线,、则所得溶液浓度________0.1 mol/L(填“大下”、“等于”或“小于”,下同).若移液时,容量瓶内已有少许蒸馏水,则所得溶液浓度________0.1 mol/L.
(4)根据计算得知,所需质量分数A 98%、密度为1184 g/cm3的浓硫酸的体积为________mL(保留一位小数).
查看答案和解析>>
科目: 来源:广西桂林十八中2012届高三第一次月考化学试题 题型:058
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极.

(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为________;
③计算电极b上生成的气体在标准状态下的体积:________;
④电极c的质量变化是________g;
⑤电解前后各溶液的PH大小是否发生变化(填变大、变小、不变):
甲溶液________;乙溶液________; 丙溶液________.
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
________.
查看答案和解析>>
科目: 来源:山东省诸城市2012届高三10月月考化学试题 题型:058
X、Y、Z、W、V为前四周期常见的五种元素,其中四种为短周期元素.X原子核外电子数等于其电子层数;常温常压下,Y单质固体难溶于水而易溶于CS2;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属.
请回答下列问题:
(1)写出实验室通过加热制备z单质的离子方程式________;
(2)W的两种常见氧化物中阳离子和阴离子个数比为2∶1的是________(写化学式);
(3)写出X、Y、W三种元素组成的化合物的水溶液与Z单质反应的离子方程式________(可不配平);
(4)检验V的最高价简单离子常用的试剂是________;
(5)将12 g Y单质完全燃烧的产物通入100 mL 1.2 mol·L-1的氢氧化钠溶液中,所得溶液中含有的主要离子分别是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com