
科目: 来源:上海市闵行区2013年高考一模化学试题 题型:058
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、物质性质的探究等实验(图中夹持装置省略).

请按要求填空:
1.实验室制取SO2气体时,可选择的合适试剂________(选填编号).
a.10%的H2SO4溶液
b.80%的H2SO4溶液
c.Na2SO3固体
d.CaSO3固体
相应的制取装置是________(填上图中装置下方编号).
2.实验室若用装置①来制取H2S气体,可选择的固体反应物是________(选填编号).
a.Na2S固体
b.NaHS固体
c.FeS固体
d.FeS2固体
3.如何检验装置①的气密性?简述其操作:________.
4.若用装置③来证明SO2具有氧化性,其实验中可能观察到的现象是________.
5.实验室里可用浓硫酸和无水酒精反应制取乙烯,除了题中的仪器外,制取装置中还缺少的玻璃仪器是________.
6.该化学兴趣小组为探究乙酸、碳酸和苯酚的酸性强弱,依次选择了装置①、②、④,其中装置②盛有的试剂是________,装置④盛有的试剂是________.
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:058
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:058
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:058
在室温和一个大气压强下,用下图所示的装置进行实验,测得a g含CaC2 90%的样品与水完全反应产生的气体体积为b L.现欲在相同条件下,测定某电石试样中CaC2的质量分数,请回答下列问题:
(1)CaC2和水反应的化学方程式是:________
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是:________.

(3)本实验中测量气体体积时应注意的事项有:________.
(4)如果电石试样质量为c g,测得气体体积为d L,则电石试样中CaC2的质量分数计算式:w(CaC2)=________.(杂质所生成的气体体积忽略不计)
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:甘肃省天水一中2012届高三百题集化学试题 题型:058
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
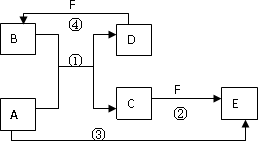
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为________,反应④的化学方程式为________.
(2)若A是常见的金属单质,D、F是气态单质,且反应①在水溶液中进行.反应②也在水溶液中进行,其离子方程式是________,已知常温下D与F反应生成B,
写出该反应的化学方程式________.
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为________.
查看答案和解析>>
科目: 来源:辽宁省葫芦岛一高中2012届高三上学期第一次月考化学试题 题型:058
某课外活动小组设计了如图所示的实验装置进行实验,回答下列问题∶

(1)开始实验时夹子e是打开的,锥形瓶A中发生反应的离子方程式为∶________,试剂瓶B中可以观察到的现象是________.
(2)数分钟后夹上夹子e,则试剂瓶B中可以观察到的现象是________,B中反应的离子方程式是________.
(3)如果开启活塞f放掉约![]() 液体,此时试剂瓶B中可能出现的现象是________,B中反应的化学方程式是________.
液体,此时试剂瓶B中可能出现的现象是________,B中反应的化学方程式是________.
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三下学期质量检测(三)化学试题 题型:058
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为:________.
(2)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如下图所示.
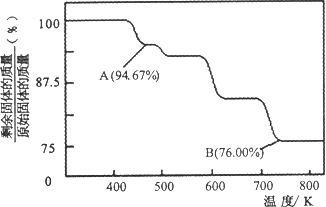
①A点时剩余固体的成分是________(填化学式).
②从开始加热到750 K时总反应方程式为________.
(3)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31].
①电解过程中NaCl的作用是________.
②已知电解后的溶液中c(Fe3+)为2.0×10-13 mol·L-1,则溶液中c(Cr3+)为________mol·L-1.
查看答案和解析>>
科目: 来源:江苏省扬州中学2012届高三下学期质量检测(三)化学试题 题型:058
某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0 g样品溶解于适量水中,向其中加入含AgNO3 2.38 g的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀.然后用含Fe3+的溶液作指示剂,用0.2 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度.请回答下列问题:
(1)滴定反应达到终点的现象是________;
(2)实施滴定的溶液以呈________(选填“酸性”、“中性”或“碱性”)为宜,加
________(填化学式)试剂可达到这一目的;
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果________(选填“偏高”、“偏低”或“无影响”);
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n(Clˉ)测定值偏低,这说明两者的溶解度:AgCl________AgSCN(填“>”或“<”);
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0 mL,则原氯化锶样品的纯度为________.
查看答案和解析>>
科目: 来源:上海市嘉定区2013年高考一模化学试题 题型:058
某同学进行试验探究时,欲配制1.0 molL-1 Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.
为探究原因,该同学查得Ba(OH)2·8H2O部分溶解度数据,见下表:
1.烧杯中未溶物仅为BaCO3,理由是________.
2.假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题纸上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管

3.将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量.
实验如下:①配制250 mL 约0.1 mol·L-1Ba(OH)2·8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,搅拌,将溶液转入________,洗涤,定容,摇匀.②滴定:准确量取25.00 ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将________(填“0.020”、“0.05”、“0.1980”或“1.5”)molL-1盐酸装入50 ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
4.室温下,________(填“能”或“不能”) 配制1.0 mol·L-1Ba(OH)2溶液,说明理由________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com