
科目: 来源:福建省惠南中学2007届高三第一学期期中考试 化学试卷 题型:058
| |||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2004年全国普通高等学校招生全国统一考试 化学(广东卷) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:2004年普通高等学校招生全国统一考试 化学(上海卷) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:2004年普通高等学校招生全国统一考试 化学(上海卷) 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:2005年普通高等学校招生全国统一考试、化学 题型:058
| |||||||||||||||
查看答案和解析>>
科目: 来源:2006年五月理科综合模拟化学部分、(第一套) 题型:058
乙二酸晶体俗称草酸,是含结晶水的无色晶体(H2C2O4·xH2O).某同学根据乙二酸的结构和碳元素的化合价,预测乙二酸的性质并进行实验验证.
性质预测:
(1)乙二酸有酸性,且酸性比乙酸强
(2)乙二酸晶体受热分解:H2C2O4·xH2O![]() CO2↑+CO↑+(x+1)H2O
CO2↑+CO↑+(x+1)H2O
(3)乙二酸能发生酯化反应
实验验证:
实验用品:0.1 mol·L 乙二酸溶液,0.1 mol·L?/SUP>乙酸溶液,乙二酸晶体;其他试剂和仪器任选.
(1)验证乙二酸酸性比乙酸强,简述其实验操作及现象:________.
(2)利用下列仪器装置检验乙二酸晶体分解的产物
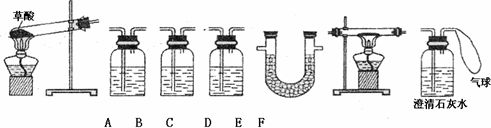
回答以下问题
①E装置中盛放的药品是________;F装置中盛放的药品是________.
②按照检验分解产物的实验流程,装置的连接顺序是(填装置的编号)A→________→________→________→________→________→________.
③按照②中流程,判断分解产物中有CO的实验现象是________.
④若将②中E装置和B装置的位置对调,不能检验出的产物是________(填化学式)
⑤若仅仅测定乙二酸晶体中结晶水的含量,必须测定的数据是________(填代号∶m1∶乙二酸晶体质量m2∶生成物水的质量m3∶生成物CO2的质量)
查看答案和解析>>
科目: 来源:陕西省西安市八校2012届高三联考化学试题 题型:058
某学生要做检验Na2CO3粉末中含有少量的NaOH和NaCl的实验.他的实验设计分为7个步骤,其中的5个步骤所用的试剂及实验操作均已写明,见下表:

试将表里尚缺的(1)、(2)两个步骤所用的试剂(自选)及实验操作补写完整,然后按实验步骤的顺序以①②③④⑤⑥⑦分别填人相应的“实验步骤”栏里.
查看答案和解析>>
科目: 来源:天津市天津一中2012届高三摸底检测化学试题 题型:058
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: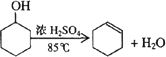

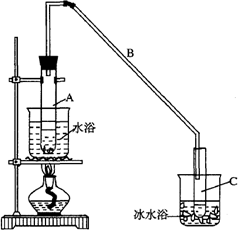
(1)制备粗品将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是________,导管B作用是________.
②试管C置于冰水浴中的目的是________.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡.静置.分层,环己烯在________层(填上或下),分液后用________(填入编号)洗涤.
a.KMnO4溶液
b.稀H2SO4
c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从________口进入.蒸馏时要加入生石灰,目的是________.
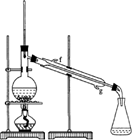
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是( )
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是________.
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
查看答案和解析>>
科目: 来源:上海市虹口区2013年高考一模化学试题 题型:058
无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾.
实验室用如下装置制备少量无水氯化铝,其反应原理为∶2Al+6HCl(g)→2AlCl3+3H2.完成下列填空∶
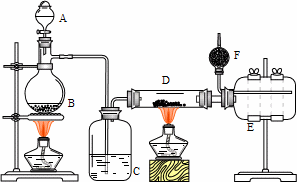
1.写出B处烧瓶中发生反应的化学方程式∶________.
2.C中盛有的试剂为________.进行实验时应先点燃________(选填“B”或“D”)处酒精灯.
3.用粗短导管连接D、E的目的是________(选填序号).
a.防堵塞
b.防倒吸
c.平衡气压
d.冷凝回流
E瓶的作用是________.
4.F中盛有碱石灰,其目的是________(选填序号).
a.吸收HCl
b.吸收Cl2
c.吸收CO2
d.吸收H2O
5.(1)将D中固体改为市售氯化铝(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是________.
(2)若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原市售氯化铝的40%,则可推算n的值为________.
6.有人建议将上述装置A、B中的试剂改为浓盐酸和二氧化锰,其余装置和试剂均不变,也能制备无水AlCl3.事实证明这样做比较危险,请简述理由________.
查看答案和解析>>
科目: 来源:上海市闵行区2013年高考一模化学试题 题型:058
碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3.
孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0 mL 0.50 mol/LCu(NO3)2溶液、2.0 mL 0.50 mol/LNaOH溶液和0.25 mol/L Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
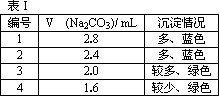
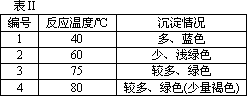
1.实验室制取少许孔雀石,应该采用的最佳反应条件:①Cu(NO3)2溶液与Na2CO3溶液的体积比为________;②反应温度是________.
2.80℃时,所制得的孔雀石有少量褐色物质的原因是________.
实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
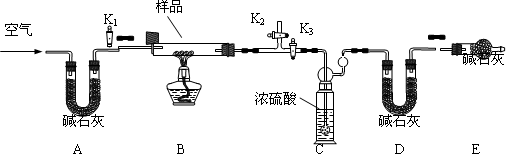
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K1、K2,关闭K3,鼓入空气,一段时间后关闭活塞K1、K2,打开K3,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
3.步骤4:________.
步骤5:称量相关装置的质量.
4.装置A的作用是________;若无装置E,则实验测定的x/y的比值将________(选填“偏大”、“偏小”或“无影响”).
5.某同学在实验过程中采集了如下数据:
a.反应前玻璃管与样品的质量163.8 g
b.反应后玻璃管中残留固体质量56.0 g
c.装置C实验后增重9.0 g
d.装置D实验后增重8.8 g
为测定x/y的比值,你认为可以选用上述所采集数据中的________(写出所有组合的字母代号)一组即可进行计算.
6.根据你的计算结果,写出该样品组成的化学式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com