
科目: 来源:安徽省宿州市2008年高三第二次教学质量检测理科综合(化学)试题 题型:058
| |||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:2008年中山纪念中学5月份化学模拟试题 题型:058
盐R的化学工为XmYnZp(X、Y、Z为三种不同离子),其组成元素均为短周期元素,取两份等质量等浓度R的水溶液进行如下实验:
Ⅰ.取一份R的水溶液与过量的Ba(OH)2溶液反应,反应过程中生成白色沉淀,沉淀量先增加后减少,最终剩余沉淀甲4.66 g,且甲不溶于稀盐酸;
Ⅱ.取另一份R的水溶液与过量的NaOH溶液混合加热,生成具有刺激性气味的气体乙0.224 L(标准状况),乙能使湿润的红色石蕊试纸变蓝.据此回答:
(1)写出R和甲的化学式:R________;甲__________.
(2)另取500 mL R的水溶液,向其中逐滴加入NaOH溶液,所得沉淀与加入的NaOH的物质的量关系如图所示.则:

①B点处溶液中离子浓度从大到上的顺序是________.
②R溶液的物质的量浓度为________________.
③BC段表示的含义是________________.
④CD段表示的含义是________________.
查看答案和解析>>
科目: 来源:山西省实验中学2007-2008学年高三年级第一次月考试题、化学 题型:058
某研究性学习小组的同学对绿矾受热分解的情况进行探究.
(1)资料表明,在加热条件下三氧化硫具有比较强的氧化性.甲同学认为,绿矾受热分解的产物是FeO、SO3、H2O.你支持甲同学的观点吗?说明你的理由
________________________________________________________;
(2)实验是解决问题的重要手段.乙同学用如下装置通过实验来探究绿矾受热分解的产物情况(加热及夹持装置未画出):

实验过程中发现:装置A中有残留固体,装置B中无水硫酸铜变蓝,装置C中的U形管中有无色晶体出现.回答下列问题:
①在装置C导管出口处还应有的实验现象是________________________;
②装置A中残留的固体是________;装置C中的U形管中无色晶体是________;
③乙同学为了验证绿矾受热分解的所有产物,在C装置后连接了一个装置,并选用了合适的药品不仅达到了实验目的的而且还起到了一举两得的效果.请你在下面的方框中画出该装置,并注明选用的药品.

④写出绿矾受热分解的化学方程式________.
查看答案和解析>>
科目: 来源:山西省实验中学2007-2008学年高三年级第一次月考试题、化学 题型:058
测定硫酸铜晶体(CuSO4·5H2O)里结晶的水的含量,实验步骤为(1)研磨;(2)在坩埚中称量样品m g,并记录装有试样的坩埚的质量m1 g;(3)加热;(4)冷却;(5)称量;(6)重复(3)-(5)的操作,直到连续两次称量的质量差不超过0.1 g为止,记录最后所得数据m2 g;(7)根据和实验资料计算硫酸铜结晶水含量.请回答下列问题.
(1)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、托盘天平(带砝码)、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是:________
(2)在用托盘天平称量空坩埚的质量时,如果天平的指标向左偏转,说明
________________________________________________________
(3)该实验中步骤(4)应在________(填仪器名称)中进行,这样操作的目的是________,否则测定结果会________(填偏高、偏低)
(4)实验步骤(6)的目的是________________________________
(5)根据测得的资料,计算观硫酸铜晶体里结晶的水的分子数________
(6)若操作正确而实验测得硫酸铜晶体中结晶的水含量偏低,其原因可能有(填选项的编号)________.
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用坩埚完全干燥
查看答案和解析>>
科目: 来源:山西省实验中学2007-2008学年高三年级第一次月考试题、化学 题型:058
电解原理在化学工业中有广泛应用.
下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
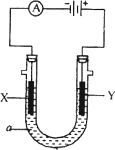
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为________.
在X极附近观察到的现象是________________.
②Y电极上的电极反应式为________.
检验该电极反应产物的方法是________________.
(2)如果要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是________,电极反应式是________.
②Y电极的材料是________,电极反应式是________.
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目: 来源:北京市海淀区2007~2008学年度高三年级第一学期期中练习、化学试题 题型:058
| |||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:肇庆市2007届高中毕业班第一次统检测化学 题型:058
苯甲酸甲酯:(![]() )是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化.
)是重要的工业原料,经酯化和水解反应可进行苯甲酸甲酯的合成和皂化.
有关物质的物理性质见下表.
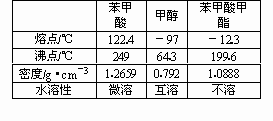
Ⅰ苯甲酸甲酯的合成和提纯.
第一步:将过量的甲醇和苯甲酸混合加热发生酯化反应;第二步:水洗提纯;第三步:蒸馏提纯.
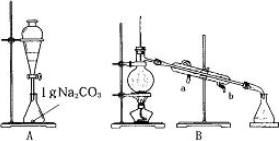
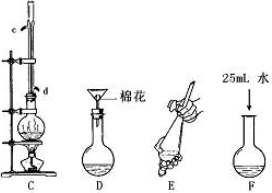
(1)上述是合成和提纯的有关装置图,请写出合成和提纯苯甲酸甲酯的操作顺序(填字母)C→F→________→________→________→________.
(2)C装置中除了装有15.0 g苯甲酸和20.0 mL过量的甲醇外,还需要加入________、________.
(3)步聚F向酯化完成后,卸下的烧瓶中加入25 mL水的作用是________;A装置中固体Na2CO3作用是________.
(4)步骤E的操作要领是________.
(5)装置A的分液漏斗中液体分为两层,苯甲酸甲酯应在________(填上、下)层;B装置蒸馏时,接收苯甲酸甲酯前(温度<199.6℃)锥形瓶中得到的物质是________.
(Ⅱ)苯甲酸甲酯的皂化反应
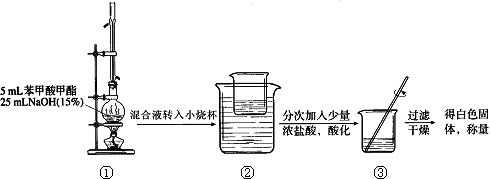
(6)装置①中冷凝管的作用是:________;
能说明①装置中反应完全的现象是________.
(7)在③中得到白色固体的质量为5.9 g.假设反应(Ⅰ)和反应(Ⅱ)中:蒸馏提纯的效率为66.7%,加浓盐酸苯甲酸钠生成白色固体的转化率为80%,其它步骤的转化效率为100%,请计算酯化反应中苯甲酸的转化率,写出简要计算过程:
查看答案和解析>>
科目: 来源:点击高考中创新性试题、化学 题型:058
为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验.(图中铁架台、铁夹和加热设备均略去)
实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y.(如图)
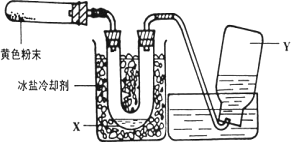
回答下面问题:
(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是________.
(2)液体X可能是________;气体Y可能是________.
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意________,理由是________.
(4)用简单的实验证实(2)中的判断
①对X的判断
②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
查看答案和解析>>
科目: 来源:广东北江中学2007高三第二轮定量实验专题练习、化学 题型:058
| |||||||||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:广东北江中学2007高三第二轮定量实验专题练习、化学 题型:058
| |||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com