
科目: 来源:广东省惠州市第八中学2008届高三化学模拟试题(8) 题型:058
某无色溶液中含有K+、Cl-、OH-、SO![]() 、SO
、SO![]() ,检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水.其中OH-不必检验,其他阴离子的检验过程如下图所示.
,检验溶液中所含的各阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水.其中OH-不必检验,其他阴离子的检验过程如下图所示.

(1)图中试剂①~⑤溶质的化学式分别是:
①________,②________,③________,④________,⑤________.
(2)图中现象a、b、c表明检验出的离子分别是:a________、b_________、c________.
(3)白色沉淀A加试剂②反应的离子方程式是________.
(4)无色溶液A加试剂③的主要目的是________.
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是________.
(6)写出气体B与试剂④反应的离子方程式________.
查看答案和解析>>
科目: 来源:广东省惠州市第八中学2008届高三化学模拟试题(8) 题型:058
乙醛是一种常用的有机试剂,也象葡萄糖一样在碱性和加热条件下,能与银氨溶液反应析出银.如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,因此这个反应又叫银镜反应.银镜的光亮程度与反应条件有关.同学们在课外活动中对乙醛的银镜反应进行了探究.
Ⅰ、探究银镜反应的最佳实验条件
部分实验数据如下表:

请回答下列问题:
(1)读表若只进行实验1和实验3,其探究目的是________.
(2)推理当银氨溶液的量为1 mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是________;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的___________________.
(3)进一步实验若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
________________________________________________.
Ⅱ、探究对废液的回收处理
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费.通过查找资料,已知从银氨溶液中提取银的一种实验流程为:
操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉.反应的化学方程式为:Ag2S+Fe+2HCl2 Ag+FeCl2+H2S↑
(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为________,需要用到的玻璃仪器有________(填编号).
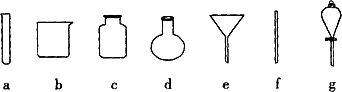
(5)操作④应在(填实验室设备名称)________中进行.
(6)要洗去试管壁上的银镜,采用的试剂是________(填名称).
查看答案和解析>>
科目: 来源:广东华附2008届高三5月月考化学试卷 题型:058
工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:NH3+CO2+H2O→NH4HCO3……①
NH4HCO3+NaCl(饱和)→NaHCO3↓+NH4Cl……②
将所得碳酸氢钠晶体加热分解后即可得到纯碱.(纯碱样品中Na2CO3的质量分数为92%~96%)请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因________.
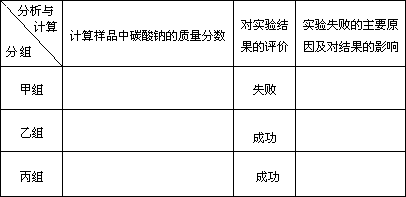
(2)现有甲、乙、丙三个小组学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下.
甲组:取10.00 g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52 g.
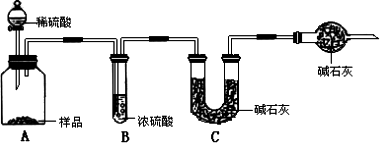
乙组:取10.00 g样品,配成1000 mL溶液,用碱式滴定管量取25.00 mL放入锥形瓶中,加入2滴酚酞作指示剂,用0.150 mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+HCl→NaCl+NaHCO3).完成三次平行实验后,消耗盐酸体积的平均值为15.00 mL.
丙组:取10.00 g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量.反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99 g.请分析、计算后填表:
查看答案和解析>>
科目: 来源:广东华附2008届高三5月月考化学试卷 题型:058
某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如图.某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,选择你认为完全正确(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论)的选项________(多选倒扣分).
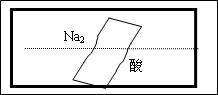
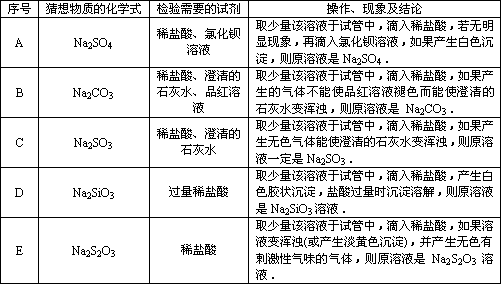
除上述五种可能之外,写出你认为还有可能物质的化学式(1种):________
查看答案和解析>>
科目: 来源:福建省福州市2008届高三化学六所名校联合考试试题 题型:058
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
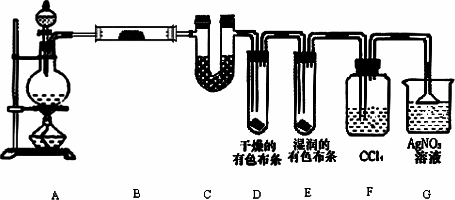
(1)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12 L的原因是________________________________.
(2)①装置B中盛放的试剂名称为________,作用是________,现象是________________.
②装置D和E中出现的不同现象说明的问题是_______________.
③装置F的作用是________.
④写出装置G中发生反应的离子方程式________.
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称).
查看答案和解析>>
科目: 来源:成都市2008届高中毕业班第三次诊断性检测理科综合能力测试化学卷 题型:058
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为FeSO4·(NH4)2SO4·6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100 g水)如下表:

下图是模拟工业制备硫酸亚铁铵晶体的实验装置.

回答下列问题:
Ⅰ.(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS等),再用清水洗净.用氢氧化钠溶液煮沸的目的是________________.
(2)将处理好的铁屑放人锥形瓶中,加人稀硫酸.锥形瓶中发生反应的离子方程式可能为________________ (填序号).
A.Fe+2H+=Fe2++H2↑
B.Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++S2-=2Fe2++S↓
D.2Fe3++Fe=3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞________,打开活塞________(填字母).容器③中NaOH溶液的作用是________________;向容器①中通入氢气的目的是________________.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是_____________;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是________、________、________________.
Ⅲ.制得的硫酸亚铁铵晶体中往往含有极少量的Fe3+.为测定晶体中Fe2+的含量,称取一份质量为20.0 g的硫酸亚铁铵晶体样品,制成溶液.用0.5 mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化,MnO4-被还原成Mn2+时,耗KMnO4溶液体积20.00 mL.
滴定时,将KMnO4溶液装在________(酸式或碱式)滴定管中,判断反应到达滴定终点的现象为________________;晶体中FeSO4的质量分数为________.
查看答案和解析>>
科目: 来源:潮州市2008年高考第二次模拟测试、化学试题 题型:058
富马酸亚铁FeH2C4O4,商品名富血铁,含铁量高,是治疗缺铁性贫血常见的药物.某校研究性学习小组通过查阅大量资料后,决定自行制备富血铁并检测其含铁量.
富马酸(HOOC-CH=CH-COOH)的性质:

Fe2+的性质:

Ⅰ、富马酸亚铁的制备
①将适量的富马酸置于100 ml烧杯中,加水20 ml在热沸搅拌下,加入Na2CO3溶液10 ml,使其pH为6.5~6.7;
②将上述溶液转移至100 ml圆底烧瓶中,装好回流装置,加热至沸;
③缓慢加入新制的FeSO4溶液30 ml,维持温度100℃,充分搅拌1.5小时.
④冷却、过滤,洗涤沉淀,然后水浴干燥,得到棕色粉末.
试回答:
步骤①中加入Na2CO3,反应的离子方程式________(富马酸及其酸根用化学式表示).
步骤①中反应后控制溶液pH为6.5~6.7;若反应后溶液的pH太小,则引起的后果是________.若反应后溶液的pH太大则引起的后果是________.
Ⅱ、产品纯度测定
准确称取富血铁0.3200 g,加煮沸过的3 mol/L H2SO4溶液15 ml,待样品完全溶解后,加煮沸过的冷水50 ml和4滴邻二氮菲-亚铁指示剂,立即用(NH4)2Ce(SO4)3(硫酸高铈铵)0.1000 mol/L标准溶液进行滴定.直至溶液刚好变为浅蓝色即为终点.测得其体积为18.50 mL,计算样品中富血铁的质量分数,写出计算过程.(Fe2++Ce4+=Fe3++Ce3+)
查看答案和解析>>
科目: 来源:潮州市2008年高考第二次模拟测试、化学试题 题型:058
工业上生产红矾(重铬酸钠Na2Cr2O7)的原料为铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2).某研究性学习小组模拟工业生产红矾的原理制备红矾,并以红矾为原料制备少量的重铬酸钾(K2Cr2O7).实验流程为:

已知焙烧时Al2O3、SiO2发生反应:
SiO2+CaCO3![]() CaSiO3+CO2↑ Al2O3+Na2CO3
CaSiO3+CO2↑ Al2O3+Na2CO3![]() 2NaAlO2+CO2↑
2NaAlO2+CO2↑
焙烧时铬铁矿发生反应:
4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①应将反应物装在________(填仪器名称)中焙烧;步骤④需要用到的玻璃仪器________________.
(2)步骤③用硫酸将溶液的pH调至7~8,目的是________________;并写出有关的离子方程式________________.
(3)滤液加入硫酸酸化过程中,溶液由黄色变为橙色,反应的离子方程式为________________.
(4)将红矾钠与KCl固体1∶2(物质的量比)混合溶于水后经适当操作可得到K2Cr2O7晶体.②③④的实验操作方法分别是________________.

查看答案和解析>>
科目: 来源:潮州市2008年高考第二次模拟测试、化学试题 题型:058
某研究性学习小组将15 mL氯气慢慢溶于1000 mL自来水,发现溶于自来水后的溶液黄绿色很浅,接近无色.为探究氯气溶于自来水中是否可与水反应,某同学作出如下假设:
①氯气溶于自来水,不与水反应;②氯气溶于自来水,可与水反应.
(1)甲同学(甲、乙为小组成员)设想用测定pH的方法探究以上假设.请你利用甲同学刚制得的液体,帮助甲同学设计实验方案.实验中可选用下列仪器、用品和药品:玻璃片、玻璃棒、pH试纸(含比色卡),石蕊试液、酚酞、蒸馏水、自来水、烧杯、胶头滴管、pH计(使用时将待测液加入烧杯中,把pH计插入待测液中,待读数稳定后,直接读取溶液的pH值).
写出实验步骤(不必填满,也可根据你的设计添加步骤④…),
①________________________________.
②________________________________.
③________________________________.
(2)乙同学设想选用AgNO3溶液探究上述问题,该设想是否正确,并解释原因.答:________________________________.
查看答案和解析>>
科目: 来源:潮州市2008年高考第二次模拟测试、化学试题 题型:058
削过皮的苹果过一段时间后颜色就会由白色变为褐色,食品科学上称为“褐变”.某研究性学习小组查阅有关资料,发现不同文献解释不同.
Ⅰ、《化学教学》:苹果中Fe2+被空气中的O2氧化成Fe3+而变色.
Ⅱ、《中学化学教学参考》:苹果中的酚类物质在苹果中的氧化酶催化下被空气中的O2氧化而生成有色物质.
已知酚类物质遇FeCl3溶液常发生颜色反应而呈现一定颜色.如苯酚显紫色,对苯二酚显绿色,甲基苯酚显蓝色.
(1)为探究苹果“褐变”是否为I的原因,小组设计了如下实验:①刚削皮的苹果立刻滴上2~3滴A溶液,继而再滴上几滴氯水.②在“褐变”后的苹果滴上2~3滴A溶液.
回答下列问题:
A溶液是________溶液(填化学式).若I的解释正确,写出①中有关的离子方程式:________________________________;
实验①②的实验现象应为:①________________________.
②________________________.
经实验,①②均无明显现象.说明观点I的解释是错误的.
(2)为探究苹果“褐变”是否为II的原因,小组又设计了如下实验.在表中填写实验①②探究目的和结论.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com