
科目: 来源:2008年普通高等学校招生全国统一考试(江苏卷)、化学 题型:058
工业上制备BaCl2的工艺流程图如下:
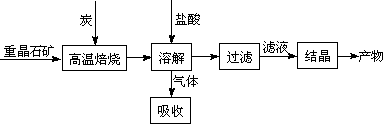
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验.查表得
BaSO4(s)+4C(s)![]() 4CO(g)+BaS(s) △H1=571.2 kJ·mol-1 ①
4CO(g)+BaS(s) △H1=571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)![]() 2CO2(g)+BaS(s) △H2=226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) △H2=226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.Na2S水解的离子方程式为________________.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =________.
=________.
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g)![]() 2CO(g)的△H2=________kJ·mol-1.
2CO(g)的△H2=________kJ·mol-1.
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是_____________,________________________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(江苏卷)、化学 题型:058
金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN-和金属离子的配离子M(CN)nm-的形式存在于水中.测定污水中含氰化合物含量的实验步骤如下:
①水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收.
②滴定:将吸收液调节至pH>11,以试银灵作指示剂,用AgNO3标准溶液滴定
Ag++2CN-![]() [Ag(CN)2]-
[Ag(CN)2]-
终点时,溶液由黄色变成橙红色.

根据以上知识回答下列问题:
(1)水样预处理的目的是________________.
(2)水样预处理的装置如下图,细导管插入吸收液中是为了________________.
(3)蒸馏瓶比吸收液面要高出很多,其目的是____________.
(4)如果用盐酸代替磷酸进行预处理,实验结果将________(填“偏高”、“无影响”或“偏低”).
(5)准确移取某工厂污水100 mL,经处理后用浓度为0.01000 mol·L-1的硝酸银标准溶液滴定,终点时消耗了21.00 mL.此水样中含氰化合物的含量为________mg·L-1的(以计,计算结果保留一位小数).
查看答案和解析>>
科目: 来源:重庆南开中学高2008级高三月考(5月)理科综合能力测试试卷(化学部分) 题型:058
| |||||||||||||||||||||||||||||||||
查看答案和解析>>
科目: 来源:山东海阳一中2008年高考模拟考试理科综合化学部分 题型:058
化学-化学与技术:聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出.其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产的工艺流程如下:
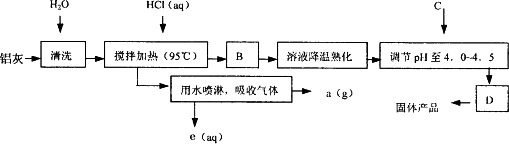
(1)搅拌加热操作过程中发生反应的离子方程式为:
______________________;______________________.
(2)生产过程中B和D的操作名称分别是________和________(B和D均为简单操作).
(3)反应中副产品a是________.
(4)生产过程中可循环使用的物质是________(用化学式表示).
(5)调节pH至4.0~4.5的目的是_________________________.
(6)实验室要测定水处理剂产品中n和x的值.为使测定结果更准确,需得到的晶体较纯净.生产过程C物质可选用________.
A.NaOH
B.Al
C.氨水
D.Al2O3
E.NaAlO2
查看答案和解析>>
科目: 来源:山东海阳一中2008年高考模拟考试理科综合化学部分 题型:058
某化学课外小组的同学为了探究碳酸钠和碳酸氢钠两种物质的性质,做了如下实验:
实验Ⅰ.如图所示.
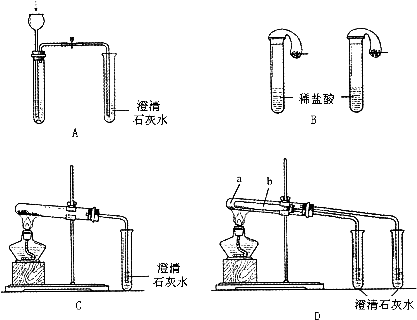
(1)若用实验D来验证碳酸钠和碳酸氢钠的热稳定性,则试管b中装入的固体最好是________,实现现象是________.
(2)若用实验来鉴别碳酸钠和碳酸氢钠两种固体,能达到实验目的的是(填装置序号)________.
(3)若测定Na2CO3固体中混有的少量NaHCO3的质量分数,C能否达到实验目的?若能,请说明其计算所需的数据)________;若不能,请简要说明理由______________________________.
实验Ⅱ.将碳酸钠与碳酸氢钠溶液分别与澄清石灰水混合并充分反应.
(1)当石灰水过量时,反应的离子方程式分别为________、________.
(2)当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为_________,请设计实验检验所得溶液中溶质的阴离子________.
查看答案和解析>>
科目: 来源:连州中学2008届高三化学第二轮复习实验题训练 题型:058
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100 mL),现邀请你参与本实验并回答相关问题.(有关实验药品为:市售食用白醋样品500 mL、0.1000 mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.实验步骤:
(1)用滴定管吸取10 mL市售白醋样品,置于100 mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却))稀释至刻度线,摇匀即得待测食醋溶液.
(2)用酸式滴定管取待测食醋溶液20.00 mL于________中.
(3)盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数.
(4)滴定,并记录NaOH的终读数.重复滴定2-3次.
Ⅱ.实验记录及数据处理
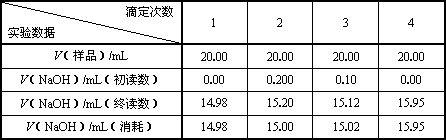
则c(样品)/moL·L-1=________;样品总酸量g / 100mL=________.
Ⅲ.交流与讨论:
(1)甲同学在处理数据过程中计算得:
V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24 mL.
试分析他的计算是否合理,如果不合理请说明理由.
________________________________________________________________.
(2)乙同学用0.1000 mol/L NaOH溶液滴定另一市售白醋样品溶液时,滴定过程中使用pH计将溶液的pH变化情况记录如下表.
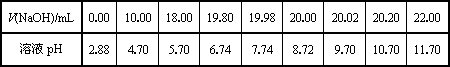
①请作出pH-V(NaOH)图.
①由表和图可知:在允许的误差范围(±0.1%)内,pH突变
(滴定突跃)范围为________.
所以可选择________作指示剂.
附:常见指示剂的变色范围

查看答案和解析>>
科目: 来源:连州中学2008届高三化学第二轮复习实验题训练 题型:058
实验室用如图所示的装置制取溴乙烷.在试管Ⅰ中依次加入2 mL蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3 g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水.加热试管I至微沸状态数分钟后,冷却.
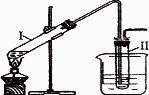
试回答下列问题:
(1)试管Ⅰ中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式________.
(2)试管Ⅰ中加入2 mL蒸馏水的目的是________.
(3)试管Ⅰ中反应除了生成溴乙烷,还可能生成的有机物有________、________(任写两种结构简式).
(4)设计实验证明试管Ⅱ收集的溴乙烷中含有溴元素,完成以下实验报告:

(5)设计实验方案,检验溴乙烷与NaOH乙醇溶液发生消去反应后生成的气体X中是否含乙烯.请在下面方框中画出实验装置图,并注明所用试剂的名称

查看答案和解析>>
科目: 来源:连州中学2008届高三化学第二轮复习实验题训练 题型:058
废旧塑料回收和利用是减轻“白色污染”、实现资源再利用的有效途径之一.某兴趣小组进行如下探究:
实验课题:废旧聚丙烯塑料热分解主要产物的探究
查阅资料:①石蜡热分解的产物为常温下的气态烃和液态烃
②CuO能将烃氧化成CO2和H2O
③苯甲酸能溶于苯
实验设计:
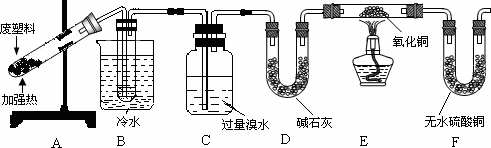
实验记录:
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E装置中黑色氧化铜变红;④F装置中无水硫酸铜变蓝.
问题讨论:请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物.若要除去其中的甲苯,实验操作方法是________
(2)C装置的作用是________;
(3)如果不设置D装置,对实验结论产生的影响是________.
(4)甲同学认为从C中出来的气体是氢气,乙同学认为还可能有其它成分.你认为其他成分可能是________.为完善实验设计,请在下图方框内画出装置图并注明其中盛放的试剂名称.

查看答案和解析>>
科目: 来源:连州中学2008届高三化学第二轮复习实验题训练 题型:058
文献资料显示,草木灰主要含有不溶性杂质及K2CO3,还含有少量KCl、K2SO4等.某化学兴趣小组拟测定草木灰中钾盐的含量及钾盐中K2CO3的含量.
测定草木灰中钾盐含量:
(1)该实验的主要步骤顺序为:称量→________→________→________→________→冷却→再称量(填字母序号)
A.溶解 B.过滤 C.洗涤、烘干 D.蒸发
(2)称量前,在调整托盘天平的零点时,若指针偏向右边,应将右边的螺丝向________(填左、右)旋动.某学生称量时,在天平右盘加上规定质量的砝码后,在左盘的小烧杯中加入样品,此时指针稍偏右边,该学生的操作应为________________________________.
(3)实验中A、B、C、D三步操作均使用了玻璃棒,操作B中玻璃棒的作用是________,操作D用玻璃棒不断搅动的原因________________________________________.
测定钾盐中K2CO3含量:
(4)取上述操作中所得的钾盐,配成稀溶液,加入CaCl2溶液使CO32-生成沉淀,过滤得到碳酸钙沉淀后,用蒸馏水多次洗涤,烘干、称量、计算.检验沉淀是否完全的方法是________________________________,检验沉淀是否洗净的方法是_______________________.
查看答案和解析>>
科目: 来源:连州中学2008届高三化学第二轮复习实验题训练 题型:058
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为_________.
某同学未加入氧化剂,而是设计了一个实验装置,也能使铜很快溶于稀盐酸.请在方格中画出该装置:

(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积________(填大于、等于或小于)100 mL.
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?________(填“可行”或“不可行”)
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?________(填“同意”或“不同意”),原因是______________________.
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论:____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com