
科目: 来源:江苏海安立发中学2008届高三第二次阶段检测化学试题 题型:058
某同学设计了如图装置,以便于准确观察铜片与稀硝酸反应的现象.c为止水夹,a、b为耐酸的多孔胶塞片(厚度1-2 mm,高度可以调整),实验过程中可以选用的试剂:铜片、稀硝酸、块状CaCO3.回答下列问题:
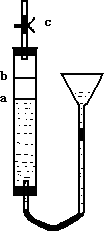
(1)写出Cu与稀HNO3反应的离子方程式________.
(2)适量的大理石放在________片上(填“a”或“b”,下同),其作用是________.
(3)欲使反应现象更为明显,则加入的铜片为________.
a.粗铜片 b.纯铜片
(4)实验操作步骤:①装好药品,打开止水夹c;②升高漏斗位置,让a片上的物质与稀硝酸接触;③充分反应后,再向漏斗中加入足量的稀硝酸至淹没b片上物质,并立即关闭止水夹c.
立即关闭止水夹c的原因是:
①________,
②________.
(5)实验中,可以观察到铜片与稀硝酸反应的现象为:
①________,②________,
③________,④________.
查看答案和解析>>
科目: 来源:湖南省示范性高级中学衡南一中2008届高三第一次月考(化学) 题型:058
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题.
[方案Ⅰ](1)称取碳酸钙样品M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积V mL.
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会________(偏高、偏低、无影响)
[方案Ⅱ](1)称取碳酸钙样品M g;
(2)用c mol/L盐酸V mL(过量)溶解样品;
(3)取溶解后的溶液![]() mL,用
mL,用![]() mol/L NaOH溶液滴定,恰好用去
mol/L NaOH溶液滴定,恰好用去![]() mL.
mL.
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯、托盘天平(砝码)、药匙之外)________.
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定________(填选项编号).
A.需要
B.不需要
C.均可
问题3:碳酸钙纯度计算公式________.
(1)称取碳酸钙样品M g;(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为![]() g.
g.
问题1:为什么要煅烧至1000℃且“直至质量不再改变”?________________;
问题2:本方案中的“冷却”应如何操作________________.
[方案Ⅳ](1)称取碳酸钙样品M g;(2)加入足量C mol/L盐酸V mL使之完全溶解;(3)过滤并取滤液;(4)在滤液中加入过量![]() mol/L Na2CO3溶液
mol/L Na2CO3溶液![]() mL;(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为
mL;(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为![]() g.
g.
问题1:此方案中不需要的数据是________(填选项编号).
A.C、V
B.![]() 、
、![]()
C.![]()
D.M
问题2:为减少实验误差,必要的操作是________(填选项编号).
A.精确测定Na2CO3溶液体积![]() mL
mL
B.精确配制浓度![]() mol/LNa2CO3溶液
mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量![]() g备用
g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钠纯度将________(偏高、偏低、无影响).
综上所述,你认为4个方案中,最好的方案是________,其它方案的缺点分别是:
方案Ⅳ:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案________;________.
方案________;________.
查看答案和解析>>
科目: 来源:浙江杭州学军中学2007-2008高三第一次月考化学试卷 题型:058
为防止碘缺乏病,通常在食盐中加入KIO3.
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是________.
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳.Na2SO4稀溶液与I2反应的离子方程式是________.
(3)已知:I2+2S2O32-=2I-+S4O62-.
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验.
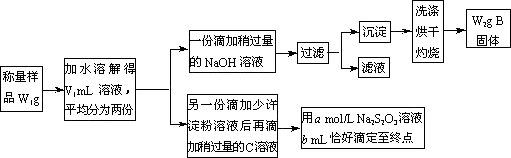
请回答下列问题:
①写出B和C的化学式:B________,C________.
②滴定时,判断滴定达到终点的现象是________.
③KIO3的质量分数是________(列出计算式).
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)________
A过滤后未洗涤所得沉淀,直接烘干灼烧
B在敞口容器中用托盘天平称量样品时,操作时间过长
C沉淀灼烧不彻底
查看答案和解析>>
科目: 来源:汕头市六都中学高三级2007-2008化学模拟试卷 题型:058
某课外小组对一些金属单质和化合物的性质进行研究.
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
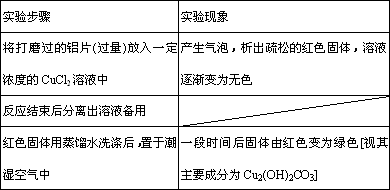
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应:________;
化合反应:________.
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡.持续电解,在阴极附近的溶液中还可观察到的现象是________.解释此现象的离子方程式是________.
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰.
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)________.
②MnO2在H2O2分解反应中作催化剂.若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是________.
查看答案和解析>>
科目: 来源:汕头市六都中学高三级2007-2008化学模拟试卷 题型:058
某学校化学兴趣小组同学在两支小试管中分别加入浓度为4 mol/L稀盐酸3 mL,将分别装有0.3gNaHCO3和0.3 g Na2CO3粉末的小气球分别套在两支试管口.将气球内的NaHCO3和Na2CO3同时倒人试管中,观察到的现象及分析如下:
(1)比较两支试管中的现象:________.
(2)若两气球内的压强相同.两试管大小相同,则大小气球体积之比约为________(填最简整数比)
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高.由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应.甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+H+(aq)=H2O(1)+CO2(g);ΔH>O;
CO32-(aq)+2H+(aq)=H2O(1)+CO2(g);ΔH<O;
甲分析结论的方法是否科学?________.(填“是”或“否”)
(4)为研究反应是吸热还是放热,乙同学继续进行下列实验.(每个实验平行做三次,取平均值)

请你帮助填写相关内容:
①该研究报告的题目是《________》
②通过上述实验可得出五条结论:
a.NaHCO3的溶解是________(“吸热”或“放热”)过程;
b.Na2CO3的溶解是________(“吸热”或“放热”)过程;
c.NaHCO3的饱和溶液和盐酸的反应是________(”吸热”或“放热”)反应;
d.Na2CO3的饱和溶液和盐酸的反应是________(“吸热”或“放热”)反应;
e.NaHCO3固体与稀盐酸反应的反应热是________(填a→d的字母)的热效应之和.
查看答案和解析>>
科目: 来源:汕头市六都中学高三级2007-2008化学模拟试卷 题型:058
晶体硅是一种重要的非金属材料.制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃.
请回答下列问题:
(1)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:________.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
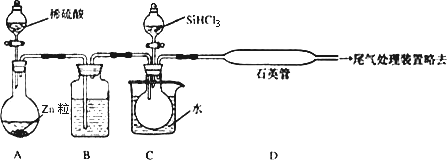
①装置B中的试剂是________,装置C中的烧瓶需要加热,其目的是:________.
②装置D中发生反应的化学方程式为________,装置D不能采用普通玻璃管的原因是________.
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________.
④为鉴定产品硅中是否含微量铁单质,请设计实验进行检验,在答题卡相应位置叙述实验操作、预期现象和结论.
查看答案和解析>>
科目: 来源:江苏省启东市汇龙中学2008届高三化学一轮复习周周测 题型:058
某待测溶液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH4+等离子,进行如下实验(所加酸、碱、氨水、溴水CO2都是过量的).
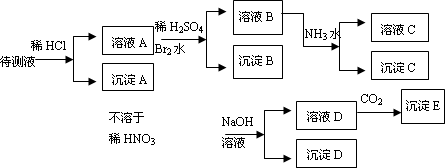
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子:________.理由是:________.
(2)写出沉淀D的分子式:________.
(3)写出从溶液D生成沉淀E的反应的离子方程式:________.
(4)写出从溶液B生成沉淀C的反应的离子方程式:________.
查看答案和解析>>
科目: 来源:江苏省启东市汇龙中学2008届高三化学一轮复习周周测 题型:058
工业上制取CuCl2的生产流程如下:
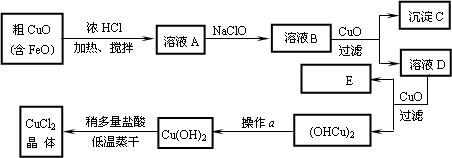
请结合下表数据,回答下列问题:
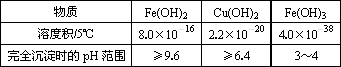
(1)溶液A中加入NaClO的目的是________;
(2)在溶液B中加入CuO的作用是________;
(3)操作a的目的是________;
(4)在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2.采用多量盐酸和低温蒸干的目的是________.
查看答案和解析>>
科目: 来源:江苏省南京市2008届高三质量检测化学试卷 题型:058
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
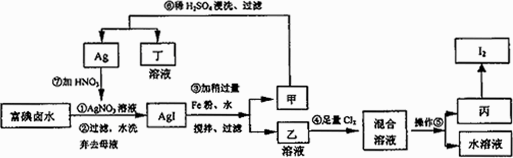
(1)步骤③加Fe粉的目的是________.
(2)写出步骤④中反应的离子方程式________.
(3)上述生产流程中,可以循环利用的副产物是________.
(4)操作⑤的名称是________,选用的试剂是________.
查看答案和解析>>
科目: 来源:江苏省淮安中学2008届高三第一次月考化学试卷 题型:058
| |||||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com