
科目: 来源:江苏省溧阳市南渡高级中学2009届高三模拟考试(化学) 题型:058
废旧塑料回收和利用是减轻
“白色污染”、实现资源再利用的有效途径之一.某兴趣小组进行如下探究:[实验课题]废旧聚丙烯塑料热分解主要产物的探究
[查阅资料]①石蜡热分解的产物为常温下的气态烃和液态烃
②CuO能将烃氧化成CO2和H2O
③苯甲酸能溶于苯
[实验设计]
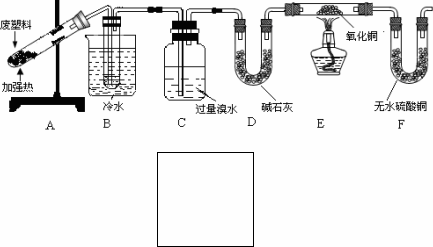
[实验记录]
①B装置试管中有液态物质生成;②C中溴水的颜色变浅;③E装置中黑色氧化铜变红;
④F装置中无水硫酸铜变蓝.
[问题讨论]请你参与实验设计的评价和实验结果的分析:
(1)经分析得知B装置试管中的液态产物是甲苯和苯的混合物.若要除去其中的甲苯,实验操作方法是________;
(2)C装置的作用是________;
(3)如果不设置D装置,对实验结论产生的影响是________;
(4)甲同学认为从C中出来的气体是氢气,乙同学认为还可能有其它成分.你认为其他成分可能是________.为完善实验设计,请在上图方框内画出装置图并注明其中盛放的试剂名称.
查看答案和解析>>
科目: 来源:江苏省金坛市第一中学2009届高三化学综合模拟 题型:058
已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1∶1.请完成下述探究混合物组成的实验.
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1 mol/L硫酸、1 mol/L硝酸、1 mol/L盐酸、1 mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水.
一、初步探究
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味.用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B.
(1)用________(填实验用品名称)取固体混合物放入烧杯中.
(2)上述实验可以得到的初步结论是:该混合物中肯定含有________,肯定不含有________.
二、进一步探究
(3)请设计实验方案进一步确定该固体混合物的组成.叙述实验操作、预期现象和结论.
查看答案和解析>>
科目: 来源:江苏省金坛市第一中学2009届高三化学综合模拟 题型:058
为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:将铜粉在坩埚中反复灼烧,与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入铜粉与稀硫酸的混合物中,向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后加CuCO3调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶得CuSO4·5H2O.滤渣可循环使用.
(3)写出加入FeSO4或Fe2(SO4)3后发生反应的相关的离子方程式:
________________________________.
第二组:过氧化氢为氧化剂法
将少量铜丝放到适量的稀硫酸中,温度控制在50℃.加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后.过滤、蒸发结晶等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O.
(4)其中用少量95%的酒精淋洗的目的是________________;
(5)上述两种氧化法中,更符合绿色化学理念的是________(填“第一组”或“第二组”),理由是________________________.
查看答案和解析>>
科目: 来源:吉林省东北师大附中2009届高三第四次摸底考试(化学) 题型:058
实验室制备溴乙烷(C2H5Br)的原理为C2H5OH+NaBr+H2SO4![]() NaHSO4+C2H5Br+H2O,装置如图(已知溴乙烷的沸点38.4℃)和步骤如下:
NaHSO4+C2H5Br+H2O,装置如图(已知溴乙烷的沸点38.4℃)和步骤如下:
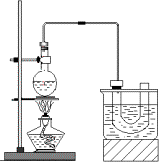
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;②在圆底烧瓶中加入研细的13 g溴化钠和几粒碎瓷片,然后加入10 mL 95%乙醇、28 mL 78%浓硫酸;③小心加热,使其充分反应.
回答下列问题:
(1)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为________
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是________.
(3)U型管内可观察到的现象是________.
(4)反应结束后,U形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的________(填序号).
A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是________(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗、分液,然后向油层中加入无水CaCl2,再进行________(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后________(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
查看答案和解析>>
科目: 来源:吉林省东北师大附中2009届高三第三次摸底考试(化学) 题型:058
用下图所示装置进行实验,将A逐滴加入B中:
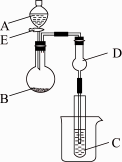
(1)若A为浓H2SO4,B为第三周期金属元素的单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是________(填化学式),B与浓H2SO4溶液反应的化学方程式为________;反应后往烧杯中加入沸水,又可观察到试管C中的现象为________.
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是________.然后往烧杯中加入沸水,可观察到试管C中的现象是________.
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是________(填名称),C是________与葡萄糖的混合液,仪器D在此实验中的作用是________.
查看答案和解析>>
科目: 来源:黑龙江省齐齐哈尔市2009届高三第一次模拟考试、化学试卷 题型:058
某课外活动小组设计如图所示装置,进行氯气的制备及有关性质实验.

(1)装置A中发生反应的离子方程式为________.
(2)上述装置中明显存在不足之处,为保证装置B中实验成功,应在装置A、B之间添加一个装置,该装置是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”)

(3)装置C中溶液发生的颜色变化为:

请在方框内填写出导致该阶段颜色变化的化学符号.
(4)装置D中起始的实验现象是________________.
(5)实验结束后,对装置A的烧瓶中残存气体的处理方法是________________.
查看答案和解析>>
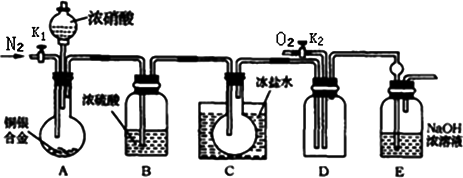
科目: 来源:河南省开封市2009届高三第一次模拟考试(化学) 题型:058
盐酸、硫酸和硝酸是中学阶段常见的三种酸.请就三种酸的有关知识,回答下列问题:
(1)化学实验室制取氯化氢气体的方法之一是将浓硫酸与浓盐酸直接滴加.请在方框内补充完整用该方法制备、收集干燥氯化氢气体及尾气处理的装置简图,并在图中标明所用试剂.(固定装置不必画出)
(2)在一定体积18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9 mol,则该硫酸的实际体积________(填大于、等于或小于)100 mL.
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗?________(填“可行”或“不可行”).
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?________(填“同意”或“不同意”),原因是________.
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,请简述实验方案、实验现象及由此得出的结论:________
查看答案和解析>>
科目: 来源:安徽省江南十校2009届高三模拟考试、化学试题 题型:058
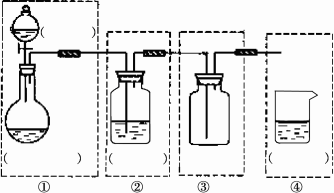
某学生设计了一套验证物质化学性质的实验装置(如下图),请完成下列问题:
(1)该实验的目的是________
(2)该实验的原理是(用化学方程式表式):________
(3)实验用品:实验仪器除铁架台(带铁夹)、储气瓶(两个)、直管活塞(K1,K2),止水夹(K3)、像皮管、橡皮塞以及若干玻璃管连件外,还有哪几种(写仪器名称):
________________________.
实验所用试剂为:________________.
(4)实验步骤:
①按上图连好仪器
②扭开活塞K1和K2;主要现象为________.
③关闭活塞K1和K2,打开止水夹K3,要使烧瓶内产生喷泉可采用的方法是:
________________________.
查看答案和解析>>
科目: 来源:浙江省杭州学军中学2009届高三上学期期中考试(化学) 题型:058
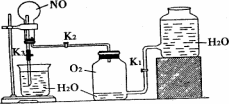
欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数.资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在.为完成测定并验证有NO生成,有人设计下图实验装置.
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___________.
(2)装置B瓶的作用是________________.
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人________(填“冷”或“热”)的氧气.
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是:_____________________.
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5 mol·L-1.实验后:A中溶液体积为40 mL,H+浓度为1.0 mol·L-1.若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________.
查看答案和解析>>
科目: 来源:山西省大同一中2008-2009学年上学期高三期中试卷(化学) 题型:058
某学习小组用下图装置测定铝镁合金中铝的质量分数和铝的相对原子质量.

(1)B中发生反应的离子方程式为
_____________________
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是_________.
然后将其洗涤,干燥,称重.
(3)实验按如下操作的顺序进行,请补充:
①按上图连接好装置.
②检查气密性,具体操作方法为___________________.
③将药品和水装入各仪器中,连接好装置,记录C的液面位置;
④由A向B中滴加足量试剂;
⑤待B中不再有气体产生并恢复至室温后,记录C的液面位置;记录C的液面位置时,除视线平视外,还应_______________.
⑥将B中剩余物质过滤,洗涤,干燥,称重.
(4)若实验用去铝镁合金的质量为a g,测得氢气体积为b ml(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________.
(5)实验步骤⑥中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________.(填“偏大”、“偏小”、“不受影响”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com