
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验基础(2) 题型:058
实验室模拟合成氨和氨催化氧化的流程如下:
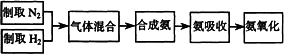
已知:实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液加热反应制取氮气.
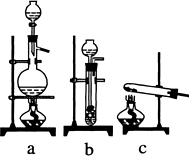
(1)从下图中选择制取气体的合适装置:氮气________、氢气________.
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________、________.
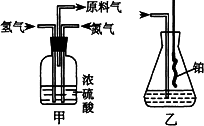
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨,________(“会”或“不会”)发生倒吸,原因是:________.
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:________,锥形瓶中还可观察到的现象是:________.
(5)写出乙装置中氨氧化的化学方程式:________.
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、________、________离子.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验基础(2) 题型:058
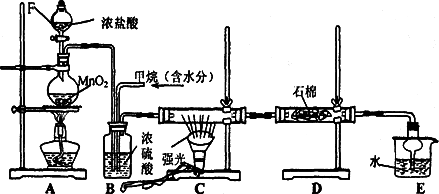
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
根据要求填空:
(1)B装置有三种功能:①控制气流速度;②________;③________;
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x的取值范围是________.
(3)D装置中的石棉上均匀附着KI粉末,其作用是________
(4)E装置的作用是________(填编号);
A.收集气体
B.吸收氯气
C.防止倒吸
D.吸收氯化氢
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式________
(6)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为________.该装置还有缺陷,原因是没有进行尾气处理,其尾气的主要成分是________(填编号)
A.CH4
B.CH3Cl
C.CH2Cl2
D.CHCl3
E.CCl4
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-硫及其化合物 题型:058
硫酸铵是一种常用的铵态氮肥.下表是硫酸铵化肥品质的主要指标.

某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究.?
[观察外观]
该硫酸铵化肥无可见机械杂质.?
[实验探究]
按图所示装置进行实验.
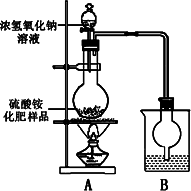
(1)烧瓶内发生反应的离子方程式为:________
烧杯中盛放的试剂最好是________(填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是________
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:________
乙同学:实验装置中还存在另一个明显缺陷是:________
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g.则该化肥________(填“是”或“不是”)一等品
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-硫及其化合物 题型:058
某混合碱是①Na2CO3和NaHCO3或②Na2CO3和NaOH.用“双指示剂法”对样品的组分和总碱量[n(Na2O)]进行测定.实验方案:称取0.2960 g样品配成500 mL溶液,取25.00 mL置于250 mL锥形瓶中,加适量蒸馏水和几滴酚酞,用0.0100 mol·L-1的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和.
(1)某同学平行滴定了三次,每次滴定从"0点开始读数,其中第Ⅰ次滴定的第一个终点的液面如图所示,请读出实验数据,填入下列表格中
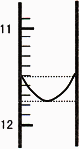

(2)该混合碱样品的组成为________,理由________.
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是________.
(4)上述碱样中总碱量[n(Na2O)]是多少?写出计算过程________.
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-硫及其化合物 题型:058
用下图装置进行SO2转化为SO3的转化率测定实验:2SO2+O2![]() 2SO3 ΔH=-196.6 kJ/mol
2SO3 ΔH=-196.6 kJ/mol

(1)要顺利进行实验,上图Ⅰ、Ⅱ、Ⅲ处各应连接1个合适的装置,请从下列A~E中选择适宜的装置,将其序号填入空格内.

Ⅰ________、Ⅱ________、Ⅲ________.
(2)实验前,必须进行的操作是(填操作名称,不必写具体过程)________
(3)实验时,浓硫酸能顺利滴入烧瓶中,甲装置所起作用的原理是:________.
(4)从乙处均匀通入O2,为使SO2有较高的转化率,实验时滴入浓硫酸与加热催化剂的先后顺序是________.
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是________若用大火加热有Cr2O3处的反应管时,SO2的转化率会________(填升高、降低或不变)
(6)实验时若用25.2 g的Na2SO3,加入的浓硫酸是足量的,反应结束时继续通入O2一段时间,称得Ⅱ处装置的质量增加11.3 g,则本实验中SO2的转化率为________.(保留3位有效数字)
查看答案和解析>>
科目: 来源:安徽省宿州市灵璧中学2009届化学第三次月考试题 题型:058
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).已知实验中可能会发生下列反应:
①2Mg+O2![]() 2MgO;
2MgO;
②3Mg+N2![]() Mg3N2;
Mg3N2;
③2Mg+CO2![]() 2MgO+C
2MgO+C
④Mg+H2O![]() MgO+H2↑
MgO+H2↑
⑤Mg3N2+6H2O![]() 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连).

回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目
________ ________________________________
________ ________________________________
________ ________________________________
________ ________________________________
(说明:可以不填满,空若不够,也可以添加.)
(2)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?________,原因是________;
(3)请设计一个简单的小实验,可以验证产物是氮化镁:________
查看答案和解析>>
科目: 来源:2009年湖南省师大附中高三第一次月考化学试卷人教版 人教版 题型:058
实验室可由软锰矿(主要成分为MnO2制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4.
请回答:
(1)软锰矿制备K2MnO4的化学方程式是________;
(2)K2MnO4制备KMnO4的离子方程式是________;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是________;
(5)上述制得的KMnO4产品0.165 g,恰好与0.335 g钝Na2C2O4反应完全,计算该KMnO4的纯度.
查看答案和解析>>
科目: 来源:2009年湖南省师大附中高三第一次月考化学试卷人教版 人教版 题型:058
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料.某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物.探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和Cu 2SO4在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
(1)若假设1成立,则实验现象是________.
(2)若假设2成立,则实验现象是有________.
(3)若固体放入足量稀硫酸中,经充分反应后,固体全部溶解,滴加KSCN试剂时,溶液不变红色,则证明假设________(填数字)成立,写出可能发生的离子方程式________.
(4)经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.实验小组欲用加热法测定Cu2O的质量分数.取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________.
查看答案和解析>>
科目: 来源:2009年湖南省师大附中高三第一次月考化学试卷人教版 人教版 题型:058
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钻玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:B________,D________.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为________.
(3)在A溶液中加少入量澄清石灰水,其离子方程式为________.
(4)C常用作净水剂,用离子方程式表示其净水原理________.
查看答案和解析>>
科目: 来源:2009年湖南省师大附中高三第一次月考化学试卷人教版 人教版 题型:058
某工厂废气中含有SO2,可将SO2转化为(NH4)2SO4而除去.其过程为:将废气经初步处理,使其中O2的体积分数为10%(这时SO2的体积分数为0.2%),并在400℃时以5 m3/h的速率通过V2 O5触媒层,然后与流量为25 L/h的NH3混合,再喷入流量为290 g/h的冷水,此时气体温度迅速从400℃下降至200℃,在结晶装置中得到(NH4)2SO4晶体.回答下列问题.
(1)使废气中SO2与O2的物质的量之比为1∶50,主要原因是________.
(2)反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表:

已知SO2的氧化是放热反应,利用表中数据推断工业上应选用________的条件进行生产,选择该条件的主要原因是________.
(3)有资料报道:“最近研制出一种性能优越的催化剂,可以将SO2全部催化氧化为SO3.”你认为该报道可信吗?________(填“可信”或“不可信”),其理由是________.
(4)合成氨时,原料N2不能用空气代替,主要原因是________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com