
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-铁铜及其化合物(1) 题型:058
红钒钠(重铬酸钠:Na2Cr2O7·2H2O,橙红色晶体)是重要的化工原料.工业铬铁矿(FeO·Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠.
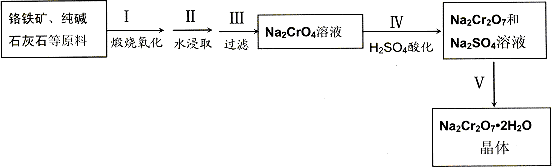
(1)步骤Ⅰ的反应有:4FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1 mol Na2CrO4转移的电子数为________mol;原料中加入CaCO3的作用是________
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
C.分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤Ⅲ过滤前要用稀H2SO4将浸取液的pH调至7~________
(3)步骤Ⅳ反应为:2CrO42-+2H+=Cr2O72-+H2O,平衡常数表达式为:K=________
下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线:
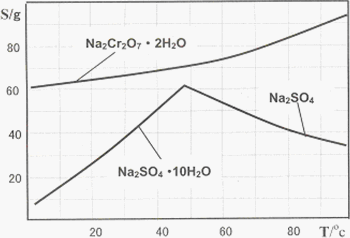
(4)据此,步骤Ⅴ操作的方法是:将IV所得溶液________(填操作),趁热过滤得到的晶体是________(填化学式);然后将所得溶液________(填操作),得到的晶体是________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-铁铜及其化合物(1) 题型:058
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)
操作Ⅱ必须用到的仪器是________.(填下列编号)
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式________,加入氨水要过量的原因是________.
(3)检验沉淀是否已经洗涤干净的操作是________.
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是________.
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是________(列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是________(写出一种原因即可)
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-铁铜及其化合物(1) 题型:058
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为三次平行实验测定结果的平均值):
方案Ⅰ:将a g铁片完全溶解于过量稀硫酸中,测得生成H2的体积为580 mL(标准状况);
方案Ⅱ:将![]() g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液.
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000 mol·L-1的KMnO4溶液滴定,达到终点时消耗了25.00 mL KMnO4溶液.
请回答下列问题:
(1)配平下面的化学方程式:
![]()
(2)根据方案Ⅰ和方案Ⅱ测定的结果计算,铁片中铁元素的质量分数分别为________和________.
(3)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析.
①方案Ⅰ________(填“准确”“不准确”“不一定准确”),理由是________________;
②方案Ⅱ________(填“准确”“不准确”“不一定准确”),理由是________________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-铁铜及其化合物(1) 题型:058
某研究性学习小组为探究铜、锌与浓盐酸反应,设计实验探究方案如下:
(一)实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化铜溶液
(二)实验记录:

(三)背景资料

(四)请你参与以下探究
(1)实验A反应速度明显比B小,原因是________.
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验C中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理?________(填是或否),理由是________.
②某同学作了如下猜想:是否成立?请你设计实验方案加以验证.

(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体.若利用资料卡片资料①②大胆猜想,白色沉淀可能是CuCl.请你帮他设计验证方案.

(4)指导老师肯定了实验D中的白色沉淀是CuCl,并指出生成沉淀的原因,实际上是沉淀溶解平衡:[CuCl4]3-(aq)![]() CuCl(s)+3Cl-(aq)移动的结果.请写出该平衡常数的表达式K=________;加水稀释后平衡移动的原因是________.
CuCl(s)+3Cl-(aq)移动的结果.请写出该平衡常数的表达式K=________;加水稀释后平衡移动的原因是________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-碳硅及其化合物 题型:058
红钒钠(重铬酸钠:Na2Cr2O7·2H2O,橙红色晶体)是重要的化工原料.工业铬铁矿(FeO·Cr2O3,含少量Al2O3和SiO2)按以下过程来制取红钒钠.
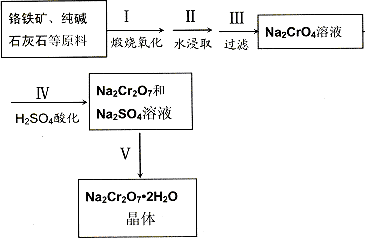
(1)步骤Ⅰ的反应有:4FeO·Cr2O3+8Na2CO3+7O2=2Fe2O3+8Na2CrO4+8CO2,生成1 mol Na2CrO4转移的电子数为________mol;原料中加入CaCO3的作用是________
A.分解产生CaO,与某些杂质反应形成炉渣
B.分解时放出大量热量,提高煅烧温度
C.分解产生CO2从下而上穿过,使得炉料翻滚,加快原料的煅烧氧化
(2)浸取液中含有铝和硅的化合物,步骤Ⅲ过滤前要用稀H2SO4将浸取液的pH调至7~8,并煮沸除去铝和硅的化合物,其离子方程式为:________
(3)步骤Ⅳ反应为:2CrO42-+2H+=Cr2O72-+H2O,平衡常数表达式为:K=________
下图是Na2Cr2O7·2H2O和Na2SO4的溶解度曲线:

(4)据此,步骤Ⅴ操作的方法是:将Ⅳ所得溶液________(填操作),趁热过滤得到的晶体是________(填化学式);然后将所得溶液________(填操作),得到的晶体是________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验探究(1) 题型:058
某研究性学习小组在整理实验室化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损,如图.某同学根据中学化学知识,对该试剂可能是什么物质的溶液进行了如下猜想和验证,请你帮他完成下表(包括猜想物质的化学式、检验需要的试剂、操作、现象及结论).(至少填出三种)

查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验探究(1) 题型:058
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O![]() NH4Cl+NaHCO3↓依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
NH4Cl+NaHCO3↓依据此原理,欲制得碳酸钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
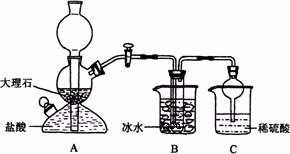
(1)A装置中所发生反应的离子方程式为:________.
C装置中稀硫酸的作用为:________.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水)
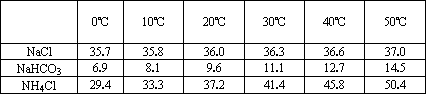
参照表中数据,请分析B装置中使用冰水是因为________.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在________装置之间(填写字母)连接一个盛有________的洗气装置,其作用是________.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为________.
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验探究(1) 题型:058
已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应).某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定.
步骤一:电解精制:
请回答以下问题:
电解时,粗铜应与电源的________极相连.阴极上的电极反应式为________电解过程中,硫酸铜的浓度会________(选填:变大、不变、变小)
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:________
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
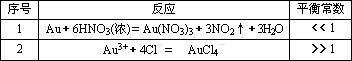
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:
___________________________________________
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:

则100 mL滤液中Cu2+的浓度为________mol·L-1,Fe2+的浓度为________mol·L-1
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验探究(1) 题型:058
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:

(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上,取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上.(填入以下所给仪器的编号)
实验所用仪器:
a、蒸发皿 b、石棉网 c、泥三角 d、表面皿 e、坩埚钳 f、试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是________
a、灼烧过程中部分氧化铜被还原
b、灼烧不充分铜未被完全氧化
c、氧化铜在加热过程中分解生成铜
d、该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是:________、________;
(5)测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验中,称量操作至少要进行________次;
(6)若测定结果x值偏高,可能的原因是________
a、加热温度过高
b、胆矾晶体的颗粒较大
c、加热后放在空气中冷却
d、胆矾晶体部分风化
查看答案和解析>>
科目: 来源:广东省2009届高三化学各地名校月考试题汇编-实验探究(1) 题型:058
某兴趣小组去一家回收含铜电缆废料的工厂做社会调查,技术人员向他们展示两个方案,并提出下列问题:
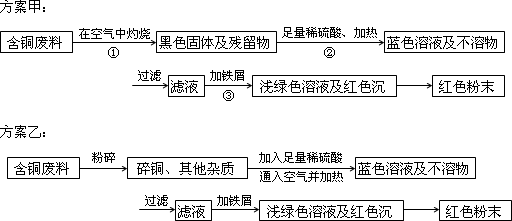
(1)两个方案哪个符合当前的绿色理念:________;
(2)写出方案甲中步骤②、⑧反应的离子方程式:________、________;
(3)无论是甲还是乙方案,在“加铁屑”时,都加入稍过量的铁屑,你认为这么做的道理是:________;
(4)①用简便的方法检验红色粉末中含有过量的铁屑:________;
②如何除去红色粉末中所含过量的Fe得干燥的红色粉末:________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com