
科目: 来源:贵州省凯里一中2009届第二轮限时训练理综化学(3) 题型:058
甲、乙、丙三位同学分别进行“Na2CO3和NaCl混合物中Na2CO3质量分数测定”的实验:
(1)甲同学实验的主要步骤有:①过滤 ②加入足量的CaCl2溶液 ③将沉淀小心烘干、称量,测得固体质量为ng ④称取mg样品溶于适量蒸馏水 ⑤洗涤沉淀2-3次.该同学正确的操作步骤为________(填序号);混合物中碳酸钠的质量分数为________(只需列出计算式).
(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,实验室中只有如下试剂:样品、6 mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液.回答下列问题:
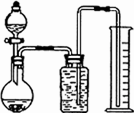
①广口瓶中盛放的溶液是________.
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是________________________
(3)丙同学准确称取w g固体混合物放入锥形瓶中,加入V1 mL 0.1000 mol/L盐酸,充分反应,用0.1000 mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL.请回答下列问题:
①实验室现有1.000 mol/L盐酸溶液.为了精确配制10 mL 0.1000 mol/L的盐酸溶液,需要的仪器有:烧杯、100 mL容量瓶、玻璃棒、________.
②滴定时选择________作指示剂,滴定终点溶液的颜色变化为________.
③混合物中碳酸钠的质量分数为________(只需列出计算式).
查看答案和解析>>
科目: 来源:贵州省凯里一中2009届第二轮限时训练理综化学(3) 题型:058
A、B、C、D、E、F均为短周期元素,A能与E形成气态AE4,其中A的质量分数为75%,E与B能形成常温呈液态的E2B型化合物,C的最高价氧化物的水化物是酸性最强的酸,D在地壳中含量仅次于B,E既能形成单原子核的阳离子,又能生成单原子核的阴离子,F是短周期中原子半径最大的原子(除稀有气体).
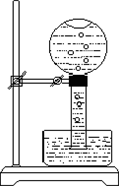
(1)工业制取D单质的化学方程式为________
(2)一小粒F单质放在石棉网上加热,反应的现象是________________
(3)AE4是含有________键(填化学键类型)的________分子(填极性,非极性).
(4)C单质和石灰乳反应的化学方程式为________;一满烧瓶C单质的水溶液如图倒置于水槽中较长时间日照后,在瓶底积蓄一定量的气体,检验该气体的操作是________.
(5)7.8克F2B2和过量的E2B反应时转移的电子数为________NA(NA为阿伏加德罗常数的值)
查看答案和解析>>
科目: 来源:贵州省凯里一中2009届第二轮限时训练理综化学(2) 题型:058
某研究性学习小组欲测定某绿色粉末Cu2(OH)2CO3·xH2O中的x值,并进行相关实验探究.
已知:Cu2(OH)2CO3·xH2O固体在加热条件下发生反应:
Cu2(OH)2CO3·xH2O![]() 2CuO+CO2↑+(x+1)H2O
2CuO+CO2↑+(x+1)H2O
(Mr[Cu2(OH)2CO3]=222;Mr(CuO)=80;Mr(CO2)=44;Mr(H2O)=18)
[实验一]测定Cu2(OH)2CO3·xH2O中的x值.
(1)准确称取m1g.该粉末样品,置于坩埚中,用酒精灯缓慢加热至完全分解,冷却,称得剩余固体的质量为m2g.加热粉末时,除了坩祸、坩锅钳、三角架、玻璃棒、酒精灯外还要用到的仪器是________,操作中需要用玻璃棒轻轻搅拌固体,目的是________所测得的x值为________(用含m1、m2的代数式表示).
(2)下列是甲、乙两位同学对实验过程中绿色粉末是否已完全分解的判断依据.
甲:观察到粉末变成黑色,不再有水蒸气逸出.
乙:重复加热、冷却、称量,至恒重(两次称量的质量差不超过0.1 g).
你认为其中合理的是________(填“甲”或“乙”).
(3)测定x值还有其它方法.下列是几位同学在实验设计中拟测定的数据,其中无法计算得出x值的是________(填序号).
①只测定生成物CO2、CuO的质量
②只测定生成物CO2、H2O的质量
③只测定反应物Cu2(OH)2CO3·xH2O和生成物CO2的质量
④只测定反应物Cu2(OH)2CO3·xH2O和生成物H2O的质量
[实验二]利用上述反应的分解产物氧化铜氧化乙醇制备乙醛(沸点为20.8℃).
(1)用如图所示装置(图中夹持装置已略去)进行实验时,需要加热的仪器是________(填标号).B装置中收集到的物质有________.

(2)能证明氧化铜氧化乙醇的实验现象是________试管A内发生反应的化学方程式为________.
查看答案和解析>>
科目: 来源:贵州省凯里一中2009届第二轮限时训练理综化学(1) 题型:058
下图中A、B、C、D、E、F、G、H均为有机化合物.
回答下列问题:
(1)有机化合物A的相对分子质量小于60,A能发生银镜反应,1 mol A在催化剂作用下能与3 mol H2反应生成B,则A的结构简式是________,由A生成B的反应类型是________;
(2)B在浓硫酸中加热可生成C,C在催化剂作用下可聚合生成高分子化合物D,由C生成D的化学方程式是________;
(3)①芳香化合物E的分于式是C8H8Cl2.E的苯环上的一溴取代物只有一种,则E的所有可能的结构简式是.____________________________
②E在NaOH溶液中可转变为F,F用高锰酸钾酸性溶液氧化生成G(C8H6O4).1 mol G与足量的NaHCO3溶液反应可放出44.8 L CO2(标准状况),由此确定E的结构简式是________
(4)G和足量的B在浓硫酸催化下加热反应可生成H,则由G和B生成H的化学方程式是________,该反应的反应类型是________.
查看答案和解析>>
科目: 来源:贵州省凯里一中2009届第二轮限时训练理综化学(1) 题型:058
某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸.
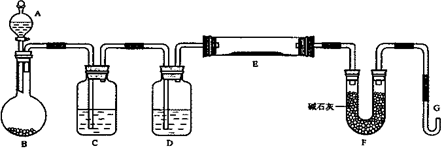
请回答下列问题.
(1)仪器中装入的试剂:B________、C________、D________;
(2)连接好装置后应首先________,其方法是________
(3)“加热反应管E”和“从A瓶逐滴滴加液体”这两步操作应该先进行的是________.在这两步之间还应进行的操作是________;
(4)反应过程中G管逸出的气体是________,其处理方法是________
(5)从实验中测得了下列数据
①空E管的质量a
②E管和WO3的总质量b
③反应后E管和W粉的总质量c(冷却到室温称量)
④反应前F管及内盛物的总质量d
⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=________;计算式2:Ar(W)=________.
查看答案和解析>>
科目: 来源:贵州省凯里一中2009届第二轮限时训练理综化学(1) 题型:058
某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4.将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”):
(1)将少许混合物放入水中得到无色溶液和白色沉淀.

(2)取溶液进行焰色反应,火焰呈黄色;

(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体.

(4)通过上述实验仍无法确定的物质是________.
查看答案和解析>>
科目: 来源:贵州省白云二中2009年化学综合测试卷两套 题型:058
某校化学实验兴趣小组为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题.

(1)请根据甲同学的意图,连接相应的装置,接口顺序:
b接________,________接________,________接a.
(2)U形管中所盛试剂的化学式为________.
(3)装置③中CCl4的作用是________.
(4)乙同学认为甲同学的实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤.你认为装置⑤应加在________之间(填装置序号).瓶中可以放入________.
(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成其他溶液.你采取的措施是________,则证明制Cl2时有HCl挥发出来.
查看答案和解析>>
科目: 来源:贵州省白云二中2009年化学综合测试卷两套 题型:058
某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子.有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜.
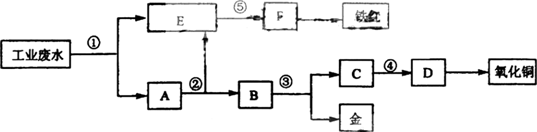
填写下面空白.
(1)图中标号处需加入的相应物质分别是①________、②________、③________、④________、⑤________;
(2)写出①处发生反应的离子方程式________;写出③处发生反应的化学方程式________;
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:铁红________;氧化铜________.
查看答案和解析>>
科目: 来源:贵州省白云二中2009年化学综合测试卷两套 题型:058
在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液.并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液.并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰.通过________(填写仪器名称)向烧瓶中加人适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________(填写下列编号字母)的净化装置.
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
_____________________________________
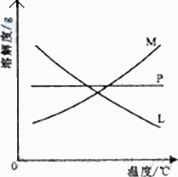
反应完毕经冷却后,②的试管中有大量晶体析出.图中符合该晶体溶解度曲线的是________(填写编号字母);从②的试管中分离出该晶体的方法是________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:

查看答案和解析>>
科目: 来源:贵州省白云二中2009年化学综合测试卷两套 题型:058
A、B、C、D四种物质均由短周期元素组成,其中A、B为酸式盐,B、C、D的焰色反应均呈黄色.相关实验及现象如下:
①取A、B的溶液,分别加入足量的Ba(OH)2溶液,分别产生白色沉淀E、F,加热过滤E后的溶液,有刺激性气味的气体放出,该气体能使湿润的红色石蕊试纸变蓝;
②向E、F中分别加入足量的稀硝酸,E溶解并产生无色无味的气体,F没有变化;
③向D的溶液中滴入少量B溶液,产生白色沉淀,该沉淀既能溶于过量的B溶液,也能溶于C的溶液.
请回答:
(1)写出化学式:B________,C________.
(2)D的溶液呈________(填“酸”、“碱”或“中”)性,其原因是(用离子方程式表示)________.
(3)D溶液中加入少量B溶液时反应的化学方程式为________;
(4)A溶液中加入过量C溶液时反应的离子方程式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com