
科目: 来源:2008-2009学年度济宁市育才中学第一学期高三期中考试、化学试卷 题型:058
海水中有非常丰富的化学资源,从海水中可提取多种化工原料.下图是某工厂对海水资源综合利用的示意图.
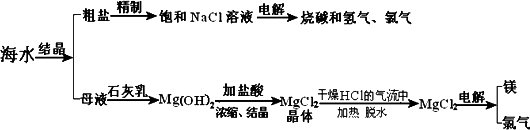
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性.请写出加入盐酸后可能发生的化学反应的离子方程式_________________.
(2)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度思考,在母液中加入石灰乳起什么作用?_________________;
Mg(OH)2沉淀中混有Ca(OH)2应该怎样除去?写出实验步骤:_________________.
(3)海水中的镁元素处于游离态还是化合态?________;从海水中提取MgCl2的反应是不是氧化还原反应?________;用电解法冶炼金属镁的反应是不是氧化还原反应?_________________.
(4)用电解法制取金属镁时,需要无水氯化镁.在干燥的HCl气流中加热
MgCl2·6H2O时,能得到无水MgCl2,其原因是________.
(5)电解无水氯化镁所得的镁蒸汽冷却后即为固体镁.请思考镁蒸汽可以在下列哪种气体氛围中冷却?_________________
A、H2
B、CO2
C、空气
D、O2
E、Ar
(6)实验室里将粗盐精制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:________________
过滤时:________________
蒸发时:________________
查看答案和解析>>
科目: 来源:2008-2009学年度北京五中第一学期高三期中考试、化学试卷 题型:058
短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1∶1的离子化合物A,X与Z能形成原子个数比为1∶1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):

(1)Y在周期表的位置是________;Z2的电子式是________.
(2)反应①的化学方程式是________.
(3)D溶液呈碱性的原因是(用离子方程式表示)________;D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净.干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去).

Ⅰ.写出反应②的离子方程式__________________.
Ⅱ.上述实验装置不够完善,改进方法是________.
(4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是
3Z2+6C![]() 5A+YZO3+3H2O,
5A+YZO3+3H2O,
3 mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是________.
查看答案和解析>>
科目: 来源:2008-2009学年度北京五中第一学期高三期中考试、化学试卷 题型:058
钢铁工业是国家工业的基础.请回答钢铁冶炼.腐蚀.防护过程中的有关问题.
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
__________________.
(2)铁是一种重要的催化剂,请写出铁在有机反应中做催化剂的化学方程式:
__________________.
(3)生产中可用盐酸来除铁锈.现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式________.
(4)下列哪个装置可防止铁棒被腐蚀________.

(5)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置示意图如下:

请回答:
①A电极对应的金属是________(写元素名称),B电极的电极反应式是________.
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol.
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因__________________.
查看答案和解析>>
科目: 来源:2008-2009学年度北京五中第一学期高三期中考试、化学试卷 题型:058
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.加热聚丙烯废塑料得到的产物如下表:
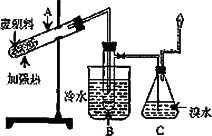
(1)试管A中残余物有多种用途,如下列转化就可以制取高聚物聚乙炔.
A中残留物![]()
写出反应②~③的化学方程式________
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有________种.
(3)锥形瓶C中观察到的现象________.经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为________.
(4)写出C中逸出的气体在工业上的两种用途________,________.
查看答案和解析>>
科目: 来源:2007-2008学年上海市嘉定一中第一学期高三年级测试(二)、化学试题 题型:058
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性:Mg和Na的化学性质也具有一定相似性.
用如图所示装置进行Mg与SO2反应的实验.
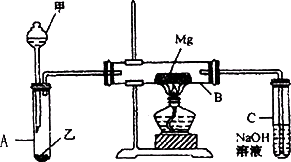
(1)选择制取SO2的合适试剂________
①10%的H2SO4溶液 ②27%的H2SO4溶液 ③Na2SO3固体 ④CaSO3固体
(2)写出装置B中发生的主要反应的化学方程式________
装置C中NaOH溶液的作用是________
(3)你认为该装置是否有不足之处?________.如果有,请说明________.
查看答案和解析>>
科目: 来源:2007-2008学年上海市嘉定一中第一学期高三年级测试(二)、化学试题 题型:058
在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案:
甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的CuO.
乙:①锌与稀H2SO4反应制H2;②将H2通入CuO中并加热,充分反应后即得纯净的Cu.
回答下列问题:
(1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量是:甲________乙(填“大于”、“小于”或“等于”),原因是________.
(2)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善.你________(填“是”或“否”)赞同丙同学的看法.
理由①(对甲学实验而言)________,
②(对乙同学实验而言)________.
(3)请你分别对甲、乙两同学的实验加以完善:
①________________
②________________
查看答案和解析>>
科目: 来源:2007-2008学年海南东方铁路中学高三第一学期化学期末考试 题型:058
电解原理在化学工业中有广泛的应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
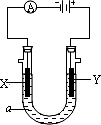
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X电极上的电极反应是________,在X极附近观察到的现象是______________.
②Y电极上的电极反应式为______________,检验该电极反应产物的方法是_____________________.
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:
①X电极的材料是________,电极反应是________.
②Y电极的材料是________,电极反应是________.
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目: 来源:2007-2008年北京四中高三年级第一学期期中测验、化学试卷 题型:058
下图是某化学小组在实验室研究二氧化硫催化氧化并制取三氧化硫晶体的装置.
(1)检查装置的气密性,加入药品后,进行实验.A装置可控制SO2和O2的进气量,理论上A中两导管(口径大小相同)冒出气泡的速率应是________,实验时中两导管冒出气泡的速率大致相同,其原因是_________________.
A处装的药品是________.C中的实验现象是________,从C端排出的尾气的成分是________,为减轻实验对环境污染,请你设计尾气处装置,用简要文字说明所加试剂及操作顺序________.
(2)已知6.4克二氧化硫氧化成气态三氧化硫放出的热量为9.83 kJ,该热化学方程式为________,若将2 mol SO2和1 mol O2充入一密闭容器反应,SO2的转化率为9%,此时Δ=________(上述反应的条件相同).
(3)若将从500℃变为400℃时,v(正)________,(填“增大”、“不变”或“减小”,下同),c(SO3):c(SO2)的比值________,SO2转化率________.
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(上海卷)、化学 题型:058
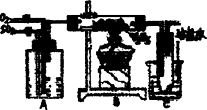
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如下图所示:
根据上述图示,完成下列天空:
(1)明矾石焙烧后用稀氨水浸出.配制500 mL稀氨水(每升含有39.20 g氨)需要取浓氨水(每升含有250.28 g氨)________mL,用规格为________mL量筒量取.
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+.检验NH4+的方法是________.
(3)写出沉淀物中所有物质的化学式________.
(4)滤液Ⅰ的成分是水和________.
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量________溶液,产生白色沉淀.
②________、________、________(依次填写实验操作名称).
③冷却、称重.
(6)若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:________mol(用含m、n的代数式表示).
查看答案和解析>>
科目: 来源:2008年普通高等学校招生全国统一考试(上海卷)、化学 题型:058
某实验小组用下列装置进行乙醇催化氧化的实验.
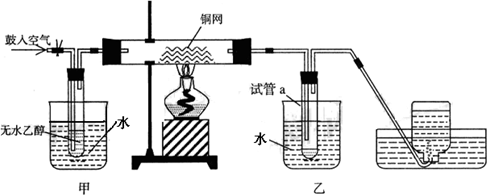
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式________、________.
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是________反应.
(2)甲和乙两个水浴作用不相同.
甲的作用是________;乙的作用是________.
(3)反应进行一段时间后,干燥管a中能收集到不同的物质,它们是________.集气瓶中收集到的气体的主要成分是________.
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________.要除去该物质,可现在混合液中加入________(填写字母).
a.氯化钠溶液
b.苯
c.碳酸氢钠溶液
d.四氯化碳
然后,再通过________(填试验操作名称)即可除去.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com